Document de principes

Les soins peau-à-peau chez les nourrissons à terme et prématurés
Affichage : le 11 janvier 2024
Auteur(s) principal(aux)
Gabriel Altit MD, Danica Hamilton inf., Karel O’Brien MD M. Sc., Comité d’étude du fœtus et du nouveau-né
Résumé
Les soins peau-à-peau (SPP) sont un aspect important des soins au parent et au nourrisson pendant la période néonatale et la première enfance. Ils doivent être entrepris immédiatement après la naissance et faire partie des soins standards dans tous les milieux, y compris à la maison. Selon de solides données probantes, les SPP ont un effet positif sur l’allaitement et l’alimentation par du lait humain, tant chez les nourrissons à terme que prématurés, de même que sur la mortalité, la stabilité cardiorespiratoire et la thermorégulation. Les SPP réduisent la douleur et le stress chez les nourrissons, accroissent l’attachement entre le parent et son nourrisson et ont des effets bénéfiques sur le neurodéveloppement de l’enfant ainsi que sur la santé mentale des parents. Le caractère sécuritaire et la faisabilité des SPP sont établis chez les nourrissons à terme et prématurés, et ces soins sont recommandés dans le cadre d’une pratique exemplaire auprès de tous les nourrissons. Les avantages des SPP sont supérieurs aux risques dans la plupart des situations, et malgré les défis qui y sont associés, les dispensateurs de soins devraient adopter des protocoles et prévoir des adaptations pour s’assurer que les SPP soient offerts, de manière que le parent, la famille, le nourrisson et l’équipe soignante vivent une expérience sécuritaire et positive. Le présentA document de principes s’adresse à toutes les familles, telles qu’elles se définissent et se déterminent elles-mêmes, et tiennent compte de l’importance de personnaliser la communication, le langage et la terminologie en matière de santé pour que l’équipe soignante réponde aux besoins particuliers de la famille.
Mots-clés : allaitement; méthode kangourou; neurodéveloppement; soins peau-à-peau
Introduction
Les soins peau-à-peau (SPP), qu’on appelle également « méthode kangourou » (MK), sont une pratique exemplaire importante pendant la période néonatale et devraient faire partie de la norme des soins pour tous les nouveau-nés en salle d’accouchement, en contexte postpartum, néonatal, pédiatrique et communautaire, de même qu’à la maison. Ils font partie intégrante de l’adaptation du nouveau-né à la vie postnatale, aident les parents à amorcer l’alimentation par du lait humain et l’attachement et améliorent le développement et la stabilité physiologique[1][2]. Les SPP peuvent être exercés à la fois en milieu de soins et à la maison, et il faut en renforcer l’importance après le congé de l’hôpital grâce à l’éducation de la famille et au soutien de l’équipe soignante. Cette intervention sécuritaire et peu coûteuse a de multiples effets bénéfiques démontrés pour les nouveau-nés, à la fois dans les pays à faible revenu, à revenu intermédiaire et à revenu élevé, et mérite de devenir une norme mondiale des soins[3].
Les SPP doivent commencer immédiatement après la naissance, quel que soit le mode d’accouchement (voie vaginale ou césarienne; tableau 1). Le nouveau-né est couché en décubitus ventral sur l’abdomen ou la poitrine nu du parent qui vient d’accoucher, sans vêtements pour les séparer. À moins que le nouveau-né ait besoin d’une réanimation néonatale avancée, ce contact devrait se poursuivre sans interruption, au moins pendant la première heure suivant l’accouchement[4], ce qui correspond à la période nécessaire pour que le nouveau-né transitionne par les phases comportementales innées qui mènent au premier allaitement[5]-[8]. Afin de favoriser une adaptation extra-utérine optimale et l’adaptation à l’alimentation par du lait humain, les SPP doivent être offerts prioritairement par le parent qui a accouché. Si ce parent se trouve dans un état instable, une autre personne désignée par le parent ou la famille peut les entreprendre.
Après le premier contact, les SPP peuvent se poursuivre en couchant le nouveau-né en décubitus ventral, vêtu seulement d’une couche, sur la poitrine nue de son parent. Si le nouveau-né est prématuré ou de petit poids, il faut soutenir les parents pour qu’ils fournissent des SPP aussi souvent et aussi longtemps qu’ils le peuvent et le désirent[4]. Une récente analyse des données probantes a incité l’Organisation mondiale de la Santé (OMS) à recommander d’entreprendre les SPP le plus rapidement possible après la naissance au sein de cette population, puis à prolonger le contact au moins huit heures par jour ou le plus longtemps possible (jusqu’à 24 heures par jour)[4]. Les SPP peuvent être interrompus si l’état du nouveau-né ou du parent qui a accouché devient instable ou si celui-ci est trop fatigué pour tenir le nouveau-né de manière sécuritaire. Dans ces situations, les SPP peuvent être assurés par l’autre parent ou une autre personne désignée.
Les soins mère kangourou (SMK) désignent un contact peau-à-peau précoce, continu et prolongé entre le parent qui a accouché et son nouveau-né, ainsi qu’une alimentation exclusive par du lait humain, même si les termes SPP, MK et SMK sont utilisés de manière pratiquement interchangeable[1]. Les SMK ont vu le jour à Bogotá, en Colombie, en réaction aux ressources limitées et au taux élevé de décès néonatals[9]. Les SMK sont également définis par des SPP ou une MK précoces et continus donnés aux nouveau-nés prématurés ou de petit poids à la naissance par le parent qui a accouché, et ce, pendant des périodes prolongées pouvant atteindre 24 heures par jour, accompagnés d’une alimentation exclusive par du lait humain, un congé précoce et la poursuite de ces soins à la maison[9]. L’équipe soignante joue un rôle de soutien important, car elle fournit de l’information respectueuse de la culture au sujet des SPP ainsi que l’équipement et les ressources nécessaires pour répondre aux besoins particuliers de la famille. Il incombe également à l’équipe soignante de décrire l’importance des SPP et d’en faciliter l’utilisation auprès de tous les nouveau-nés, quels que soient les modalités d’alimentation[10] et les soins à leur administrer[11] (tableau 2).
L’importance et les bienfaits des soins peau-à-peau
L’allaitement et l’alimentation par du lait humain
De solides données probantes tirées d’études randomisées et contrôlées et d’analyses systématiques corroborent les effets positifs des SPP sur pratiquement tous les résultats décrivant l’adoption du lait humain pour l’alimentation des nourrissons à terme et prématurés. Des études sur les nourrissons peu prématurés associaient les SPP à une augmentation du taux d’allaitement exclusif entre le congé et un mois de vie ainsi qu’à toute fréquence d’allaitement entre un et quatre mois de vie[5]. Selon des analyses systématiques et une méta-analyse, les SPP en milieu néonatal (y compris auprès des nourrissons prématurés) accroissaient le taux d’allaitement exclusif de manière significative au moment du congé et des suivis à l’âge de un, trois et quatre mois[1]-[3],[12][13]. Il est démontré que les SPP, même s’ils sont donnés pendant de courtes périodes ne dépassant pas une heure, accroissent la durée de toute forme d’allaitement[1][2]. De plus, les SPP sont associés à de plus forts volumes de lait humain exprimé et jouent un rôle important pendant la transition des nourrissons de l’alimentation par sonde à l’allaitement[2].
La mortalité
Une analyse systématique a démontré que les nouveau-nés qui reçoivent des SPP présentent invariablement des taux de mortalité plus faibles, et ce, dans diverses populations de nouveau-nés de pays aux profils économiques variés[3]. Une autre étude systématique réalisée surtout dans des pays à faible revenu ou à revenu modéré a établi que les nouveau-nés prématurés dont l’état s’était stabilisé et qui recevaient des SPP voyaient leur taux de mortalité diminuer[12]. Une vaste étude randomisée et contrôlée récente a démontré que les nouveau-nés dont le poids se situait entre 1,0 kg et 1,799 kg et qui recevaient des SMK constants amorcés immédiatement après la naissance voyaient leur survie néonatale augmenter de 25 % par rapport à ceux ayant commencé à recevoir des SMK après la stabilisation[14]. Les trois études ont également fait état d’une diminution des taux observés d’hypothermie et de sepsis présumé, qui peuvent expliquer au moins en partie le plus faible taux de mortalité au sein de cette population[3],[12],[14].
La stabilité cardiorespiratoire
Des études ont porté sur les effets des SPP sur la physiologie et l’adaptation des nouveau-nés. Dans deux études, ceux qui avaient reçu des SPP obtenaient de meilleurs scores globaux en matière de stabilité cardiorespiratoire[5]. Une récente analyse systématique des publications scientifiques a évalué uniquement les effets des SPP sur la stabilité physiologique du nouveau-né (notamment, la thermorégulation et la stabilisation). Les SPP amorcés immédiatement après la naissance étaient liés à la stabilisation des paramètres physiologiques, y compris la température, l’oxygénation et la fréquence cardiaque[15]. La sécurité et la faisabilité des SPP en milieu hospitalier ont été établies chez les nouveau-nés modérément (32 à 34 semaines d’âge gestationnel) et extrêmement (moins de 28 semaines d’âge gestationnel) prématurés, et les SPP ont été recommandés comme norme des soins dans les unités de haute et basse technologie[16]. Selon une autre analyse systématique, ils pourraient assurer une protection contre l’apnée du prématuré[17].
La prévention des infections, l’accroissement de l’immunité et les effets sur le microbiome
Il est démontré que de multiples facteurs influent sur la colonisation microbienne chez les nourrissons prématurés, y compris le recours aux antibiotiques, la consommation de lait humain et le mode d’accouchement[18]. On comprend mal le rôle des SPP dans la modification du microbiote intestinal et leurs effets sur les risques de sepsis et le développement du cerveau du nourrisson. On sait toutefois que les nourrissons prématurés qui reçoivent des SPP sont colonisés par les bactéries de leur mère, ce qui contribue à réguler leur microbiome et à réduire leur colonisation par des bactéries pathologiques après la naissance[19]-[21]. Il faut toutefois respecter les directives locales en matière de prévention et de contrôle des infections pour éviter la transmission nosocomiale ou horizontale des infections aux nourrissons.
La gestion de la douleur
De multiples analyses ont confirmé l’efficacité des SPP à soulager la douleur attribuable à des interventions chez les nouveau-nés à terme[22],[23] et prématurés[22], particulièrement lorsqu’ils sont combinés à l’allaitement. Par exemple, des SPP d’une durée d’au moins dix minutes avant une injection intramusculaire réduisent la réaction des nouveau-nés à terme à la douleur[23].
La régulation du stress
Des recherches en psychologie du développement et en santé mentale du nourrisson confirment la fonction essentielle de régulation que procure au nourrisson la présence du parent qui a accouché et le toucher parental. Dans les publications scientifiques, les principaux indicateurs de stress incluent la variabilité de la fréquence cardiaque du nourrisson, les taux de cortisol et d’ocytocine du nourrisson et de la mère et les questionnaires qui mesurent le stress de la mère[24]. Les données probantes indiquant que les SPP peuvent réguler le stress du nourrisson sont mitigées. Les protocoles des SPP variaient selon les études, et bon nombre d’entre elles comportaient un petit échantillon de sujets, différents critères d’inclusion et d’exclusion ou des groupes témoins hétérogènes[25]. Cependant, selon une récente analyse des données probantes, les SPP atténuent la variabilité de la fréquence cardiaque des nourrissons, réduisent leur taux de cortisol et accroissent leur taux d’ocytocine; tous ces effets appuient l’utilisation des SPP pour réduire le stress et comme élément essentiel de soins hospitaliers de qualité[26].
Les bienfaits neurodéveloppementaux
Les nourrissons prématurés sont plus à risque de présenter des différences neurodéveloppementales, qui peuvent se manifester de diverses façons[27], y compris une modification du fonctionnement de l’axe hypothalamo-surrénalien[28]. Selon certaines études, en milieu hospitalier, l’exposition du nourrisson à des actes médicaux nécessaires, mais stressants, la séparation d’avec ses parents et les interventions douloureuses auxquelles il est exposé sont tous des éléments qui contribuent à perturber la maturation du cerveau prématuré[29][30]. Cependant, d’après des recherches sur des modèles animaux, lors des interventions douloureuses, les soins et le soutien apportés au parent qui a accouché peuvent également contribuer à atténuer les effets négatifs du séjour hospitalier sur le cerveau en développement du nourrisson, en partie en accroissant la sécrétion d’ocytocine, un neuropeptide qui amplifie les effets tampons du soutien social sur la réponse au stress. Par ailleurs, des études ont démontré que les nourrissons qui reçoivent des SPP présentent une organisation du sommeil plus mature, un meilleur cycle de sommeil et un développement de l’électroencéphalographie à amplitude intégrée (EEGa) plus normal[31].
Une récente étude randomisée et contrôlée réalisée en Chine[32] a confirmé encore davantage l’effet des SPP sur le développement du nourrisson. Dans cette étude, les chercheurs ont comparé des nourrissons du groupe témoin qui n’avaient pas eu d’interactions avec leurs parents (conformément à la norme de soins dans cette unité néonatale) à des nourrissons du groupe d’intervention qui avaient reçu des SPP au moins une heure par jour pendant 14 jours. Ainsi, l’EEGa, les résultats neurocomportementaux aux jours sept et 14 et les résultats de l’évaluation comportementale et neurologique à l’âge de trois et six mois étaient plus satisfaisants chez les nourrissons qui avaient reçu des SPP que dans le groupe témoin. Il a également été démontré que les SPP améliorent la croissance générale du nourrisson[33] ainsi que les taux d’allaitement et d’alimentation par du lait humain, des effets qui ont une incidence positive sur le cerveau en développement du nourrisson. D’après des données émergentes, le contact visuel et vocal précoce avec les parents, facilité par les SPP, favorise le développement de l’attachement et de l’harmonisation entre le nourrisson et ses parents, et même du langage dans le cadre des premières étapes du développement et de la santé relationnelle[34]-[36].
Chez les nouveau-nés exposés à des substances psychoactives in utero qui présentent un syndrome d’abstinence néonatale (ou un syndrome néonatal de sevrage des opioïdes) ou sont susceptibles d’en présenter un, le contact assuré par les SPP est d’abord une intervention non pharmacologique de gestion des symptômes [37-39]. Dans tous les cas, les SPP réguliers encouragent la réceptivité et l’attachement des parents [40]. Les SPP favorisent de meilleurs profils de sommeil et sont associés à la fois à une diminution des besoins de traitement pharmacologique et de la durée du séjour hospitalier chez les nouveau-nés.
L’interaction entre les parents et leur nourrisson et les effets sur la santé mentale des parents
Les SPP donnent aux parents des occasions d’interactions positives avec leur nourrisson, même en soins intensifs. De l’ocytocine est libérée en réaction aux SPP avec le parent qui a accouché et l’autre parent, ce qui entraîne une baisse démontrée du stress et de l’anxiété[41]. La libération d’ocytocine encourage aussi l’attachement et l’harmonisation entre le parent et le nourrisson. Cette harmonisation incite les parents à se sentir plus en confiance et plus à l’aise de prendre soin de leur nourrisson[42]. Les analyses systématiques ont confirmé que les SPP ont un petit effet protecteur sur les scores de dépression chez les mères de nourrissons prématurés ou de petit poids à la naissance[43][44]. Selon une analyse, des interventions du parent qui n’a pas accouché auprès de son nourrisson en soins intensifs néonatals, notamment les SPP et d’autres contacts tactiles, avaient des effets positifs généraux démontrés, y compris sur la santé mentale de ce parent[45]. Les SPP sont une pratique exemplaire établie qui contribue au développement du nourrisson et à la santé relationnelle entre lui et ses parents.
Des soins peau-à-peau sécuritaires en milieu surveillé et non surveillé
Il y a déjà eu des cas de collapsus soudain et inattendu du nouveau-né associés aux SPP dans des milieux non surveillés, mais ils sont très rares (incidence estimative de 2,6 à 133 cas sur 100 000 nouveau-nés), l’inattention du parent (p. ex., à cause du manque de sommeil ou de l’épuisement) étant un facteur de risque possible[46][47]. La plupart des décès sont directement attribuables au fait d’être resté coincé, à une suffocation ou à une chute[48]. Cependant, un rapport reposant sur les données des Centers for Disease Control and Prevention a établi que l’adoption des SPP et de l’allaitement était temporellement associée à une baisse du risque de décès soudain et inattendu dans les six jours suivant la naissance[49]. Grâce à un soutien et des conseils appropriés aux parents, les SPP devraient faire partie des soins postnatals systématiques, même en milieu postopératoire.
Un membre de l’équipe soignante devrait maintenir la dyade parent-nouveau-né en observation constante immédiatement après la naissance, puis régulièrement pendant les soins postnatals[48]. Les parents devraient se faire enseigner à vérifier la respiration, l’activité, la coloration, le tonus et la position de leur nouveau-né, de même que l’absence de signe d’obstruction des voies respiratoires[48]. Si le nouveau-né est en bonne position pendant les SPP, son visage est visible, il a le cou droit ou en légère extension (position de reniflement) et la tête tournée sur le côté pour éviter de lui obstruer les voies respiratoires ou de lui couvrir la bouche. Les professionnels de la santé devraient évaluer la somnolence et l’épuisement des parents dans la foulée de l’expérience de l’accouchement et leur fournir un soutien approprié afin qu’ils offrent des SPP sécuritaires. Lorsqu’un parent a besoin de se reposer, le nouveau-né devrait être placé peau-à-peau sur l’autre parent (ou sur une autre personne éveillée et vigilante) ou, s’ils ne sont pas disponibles, dans une couchette, conformément à toutes les pratiques de sommeil sécuritaires[48]-[52].
| Tableau 1. Les soins peau-à-peau immédiatement après un accouchement par voie vaginale ou par césarienne |
|
|
Tableau 2. Des soins peau-à-peau continus accompagnés d’un soutien |
|
La médication (prescrite ou non), la consommation de substances psychoactives et un traitement aux agonistes des opioïdes peuvent provoquer la somnolence ou le sevrage chez les parents. Il faut tenir compte de ces effets pour soutenir les SPP en toute sécurité[53]. Un counseling supplémentaire peut s’imposer pour assurer des SPP sécuritaires, et les échanges avec les parents ou les membres de la famille au sujet des risques doivent être francs tout en demeurant ouverts, respectueux et dénués de jugement. Éviter les paroles stigmatisantes et donner la priorité à l’individu (p. ex., « le parent qui consomme de l’alcool »). Ces échanges sont confidentiels et ne doivent être transmis qu’après avoir obtenu l’autorisation explicite du parent qui a accouché[53][54].
Selon des études chez les nouveau-nés prématurés (y compris les extrêmes prématurés), sur le plan clinique, les signes vitaux ou les besoins en oxygène ne fluctuent pas de manière significative avant et après les SPP[55]-[59], mais ceux-ci semblent favoriser une thermorégulation plus mature, une légère augmentation de la température et une amélioration de certaines variables physiologiques[59]-[61]. Les SPP n’accroissaient pas la fréquence ni la durée des épisodes d’apnée[62][63] ou la consommation d’oxygène[64]. La plupart des études reposaient sur des séances de SPP de 60 à 90 minutes.
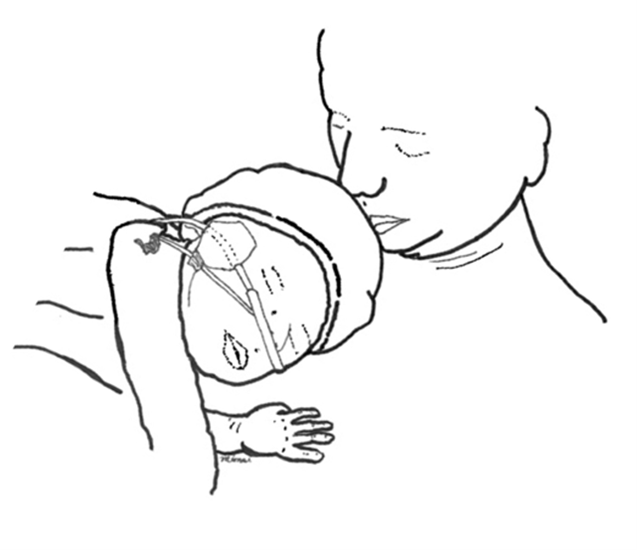
Divers rapports ont confirmé la faisabilité des SPP chez les nouveau-nés prématurés et à terme qui sont intubés[55][57][58][65][66] ou sous ventilation assistée non invasive[58]. Aucunes données probantes ne portent sur les risques d’extubation non planifiée ou de délogement des tubulures pendant les SPP[55][66][67]. Pour plus de sécurité, certains préconisent la présence de deux travailleurs de la santé pour faciliter le transfert et s’assurer que l’équipement (p. ex., la tubulure pour ventilation assistée) est bien positionné[66]. Les SPP ont également été évalués chez 25 nouveau-nés en soins intensifs à cause d’une cardiopathie congénitale[68][69]. Pendant 60 séances de SPP d’une heure, aucun événement indésirable (y compris le délogement) n’a été constaté, malgré la présence de multiples tubulures, sondes, fils et cathéters. Des centres ont décrit avoir fourni des SPP systématiques sans problèmes aux nouveau-nés ayant un drain thoracique et sous ventilation, y compris la ventilation oscillatoire à haute fréquence[70] ou la ventilation par jet[71], ce qui démontre la faisabilité des SPP auprès des nouveau-nés gravement malades. Chez les extrêmes prématurés, le report des SPP peut être justifié pendant les 72 premières heures de vie, en raison d’inquiétudes relatives à la manipulation et à la neuroprotection. Cependant, la faisabilité d’offrir des occasions de SPP à cette population pendant la même période a également été confirmée, sans accroître le taux d’hémorragies intraventriculaires[72]. En milieu surveillé, une approche d’équipe interprofessionnelle s’impose pour déterminer si chaque nouveau-né est prêt à recevoir des SPP.
Les contre-indications relatives
Les contre-indications relatives aux SPP incluent la présence d’une anomalie de la paroi abdominale ou du tube neural, l’instabilité postopératoire (ou une stabilité encore indéterminée), et une instabilité importante associée à la manipulation ou à une convalescence prolongée[70]. Pendant l’hypothermie thérapeutique, on peut tout de même envisager que le parent tienne son nourrisson[73][74]. Dans presque toutes les situations complexes sur le plan médical, les avantages des SPP sont supérieurs aux risques. Malgré les défis qui y sont associés, les dispensateurs de soins devraient adopter des protocoles et prévoir des adaptations pour s’assurer que les SPP soient offerts, de manière que le parent, la famille, le nourrisson et l’équipe soignante vivent une expérience sécuritaire et positive.
Les interventions et l’équipement
Les SPP ne devraient pas être considérés comme optionnels en milieu hospitalier, mais faire partie des soins essentiels aux nouveau-nés, même en milieu de soins à haute intensité. Puisque les SPP se généralisent, les praticiens responsables devront prévoir la présence de personnel empathique et formé, de l’équipement (p. ex., lit ou fauteuils pour un confort optimal, écrans d’intimité), du temps et de l’espace nécessaires[75]. Il faudrait qu’une équipe multidisciplinaire, incluant des familles ayant une expérience vécue, rédige les politiques et protocoles de leur établissement adaptés aux populations locales de patients (p. ex., unité de soins à haute intensité, pouponnière, unité d’hospitalisation standard). L’objectif consiste à promouvoir des occasions de SPP précoces et maximales pour les nouveau-nés et leur famille, tout en s’assurant que les parents et l’équipe soignante disposent des ressources appropriées. Certaines directives publiées, telles que celles qui sont citées dans le présent document à l’égard des soins après une césarienne[69][76], peuvent être adaptées aux conditions locales.
Le clinicien doit envisager des formations, des simulations et des exercices pratiques en compagnie des dispensateurs de soins et des parents dans une unité néonatale ou d’autres types de pouponnière, axés sur le transfert des nourrissons sous assistance respiratoire ou autre type d’assistance sur la poitrine d’un parent ou à partir de ce parent. La plupart des répondants à un sondage en ligne[77] auprès de dispensateurs de soins néonatals ont convenu qu’un dispositif d’aide aux SPP (p. ex., emmaillotage, tissu ou vêtement pour aider au bon positionnement pendant les SPP), qui permettent aux dispensateurs de soins d’accéder rapidement au nourrisson, aiderait le parent à se reposer pendant que le nourrisson est relié à un moniteur et pourrait améliorer l’expérience des parents à l’égard des SPP. Cependant, l’absence de tels dispositifs ne devrait jamais empêcher le recours aux SPP. Enfin, du personnel formé devrait être disponible en milieu de soins à haute intensité pour aider à transférer les nourrissons sous technologie d’assistance et pour surveiller les séances de SPP. Lorsque les SPP seront pleinement adoptés au Canada à titre de pratique exemplaire et de norme de soins, ils procureront une expérience sécuritaire, positive et bénéfique, tant pour les nourrissons que pour les parents.
Recommandations
Pour que les soins peau-à-peau (SPP) deviennent une pratique exemplaire établie auprès de tous les nourrissons dans tous les milieux néonatals et tous les domiciles, les recommandations suivantes s’appliquent :
- Les pédiatres et les dispensateurs de soins périnatals devraient conseiller les parents pendant la grossesse et promouvoir les SPP auprès d’eux, notamment leurs avantages pour l’allaitement, l’immunité et le renforcement du développement, la stabilité physiologique pendant la transition et l’attachement précoce.
- Les hôpitaux, les centres de naissance et les pouponnières devraient :
- faire participer les familles ayant vécu les SPP à la rédaction des politiques et protocoles s’y rapportant et s’assurer que des décisions parentales éclairées sont reflétées dans la planification de l’accouchement;
- adapter les directives sur les SPP aux conditions et exigences locales;
- former le personnel pour transférer et mettre en position les nourrissons en toute sécurité en vue des SPP, y compris ceux sous ventilation assistée ou autres technologies d’assistance;
- adopter des protocoles et prévoir des adaptations pour s’assurer que les SPP :
- commencent immédiatement après la naissance et se poursuivent sans interruption pendant au moins une heure, jusqu’à la fin du premier allaitement et l’administration des médicaments systématiques, sauf lorsque des mesures de réanimation ou d’autres soins à haute intensité s’imposent;
- sont intégrés aux interventions médicales pour contribuer à gérer la douleur et le stress du nourrisson;
- se poursuivent en milieu postopératoire et en soins à haute intensité;
- sont consignés et précisés lors des visites quotidiennes à titre d’indicateur de performance clé ou de marqueur d’amélioration de qualité.
Outre ce qui précède, l’équipe de soins néonatals devrait prendre les mesures suivantes :
- Encourager et soutenir les parents à fournir des SPP aussi longtemps et aussi souvent qu’ils le peuvent et le désirent, même si leur nourrisson est prématuré ou de petits poids.
- Expliquer et renforcer le lien entre les SPP et la production de lait humain ou l’allaitement, de même que leur importance pour l’attachement entre le nourrisson et son parent et pour la santé.
- Coordonner le transfert des nourrissons à un parent ou d’un parent avec des membres de l’équipe soignante lorsque la situation l’indique (p. ex., présence d’un inhalothérapeute si le nourrisson est sous ventilation assistée).
- Prioriser le parent qui accouche, mais savoir quand et comment faire participer l’autre parent ou un autre proche aux SPP et de qui il s’agit.
- Fournir de l’information adaptée à la culture et axée sur la famille au sujet des SPP, de même que l’équipement et les ressources nécessaires pour répondre aux besoins propres à chaque famille (p. ex., éducation, confort et intimité).
- Surveiller la fatigue des parents et déconseiller l’utilisation de substances psychoactives et de dispositions de sommeil non sécuritaires, tout en privilégiant l’ouverture, le respect et l’absence de jugement.
- Adopter une approche interprofessionnelle (en milieu surveillé) pour déterminer si les cas les plus malades peuvent recevoir des SPP.
- Consigner les SPP dans le dossier médical du nourrisson.
- Au congé hospitalier, renforcer les bienfaits que procurent les SPP et les gestes qui s’y rapportent par de l’information et un soutien aux familles.
Remerciements
Les auteurs tiennent à remercier Pamela Hamilton, qui a produit les images, et Laura N. Haiek, MD, M. Sc., qui a révisé et édité le manuscrit. Le comité des maladies infectieuses et d’immunisation, le comité de nutrition et gastroentérologie, le comité de la pédiatrie communautaire, le comité de la santé des Premières Nations, des Inuits et des Métis et le comité des soins aigus de la Société canadienne de pédiatrie ont révisé le présent document de principes. Les comités directeurs de la section de la médecine d’urgence pédiatrique, de la section de la pédiatrie du développement, de la section de la pédiatrie hospitalière et de la section de la santé des enfants et des adolescents dans le monde l’ont également révisé, de même que le groupe de travail de la petite enfance de la SCP et des membres du comité d’exercice clinique de l’Association canadienne des infirmières et infirmiers en périnatalité et en santé des femmes. Enfin, il a été révisé et approuvé par l’Association canadienne des infirmières et infirmiers en néonatologie.
COMITÉ D’ÉTUDE DU FŒTUS ET DU NOUVEAU-NÉ DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (Juillet 2022)
Membres : Gabriel Altit MD, Anne-Sophie Gervais MD (membre résidente), Heidi Budden MD (représentante du conseil), Leonora Hendson MD (membre sortante), Souvik Mitra MD, Michael R. Narvey MD (président), Eugene Ng MD, Nicole Radziminski MD
Représentants : Eric Eichenwald MD (comité d’étude du fœtus et du nouveau-né, American Academy of Pediatrics), William Ehman MD (Le Collège des médecins de famille du Canada), Danica Hamilton inf. (Association canadienne des infirmières et infirmiers en néonatologie), Emer Finan MBBCH (comité directeur de la section de la médecine néonatale et périnatale de la SCP), Chantal Nelson Ph. D. (Agence de la santé publique du Canada), R. Douglas Wilson MD (La Société des obstétriciens et gynécologues du Canada)
Auteurs: Gabriel Altit MD, Danica Hamilton inf., Karel O’Brien MD M. Sc.
Références
- Organisation mondiale de la Santé. Protecting, Promoting and Supporting Breastfeeding: The Baby-friendly Hospital Initiative for Small, Sick and Preterm Newborns. 2020. (consulté le 19 juillet 2023).
- Organisation mondiale de la Santé. Orientations de mise en œuvre : protection, encouragement et soutien de l’allaitement dans les établissements assurant des services de maternité et de soins aux nouveau-nés : révision de l’Initiative Hôpitaux amis des bébés. 2018. (consulté le 19 juillet 2023).
- Boundy EO, Dastjerdi R, Spiegelman D et coll. Kangaroo Mother Care and neonatal outcomes: A meta-analysis. Pediatrics 2016;137(1):e20152238. doi : 10.1542/peds.2015-2238.
- Organisation mondiale de la Santé. WHO Recommendations for Care of the Preterm or Low-birth-weight Infant. Genève, Suisse : OMS, 2022. https://www.who.int/publications/i/item/9789240058262 (consulté le 19 juillet 2023).
- Moore ER, Bergman N, Anderson GC, Medley N. Early skin-to-skin contact for mothers and their healthy newborn infants. Cochrane Database Syst Rev 2016;11(11):CD003519. doi : 10.1002/14651858.CD003519.pub4.
- Brimdyr K, Cadwell K, Svensson K, Takahashi Y, Nissen E, Widström AM. The nine stages of skin-to-skin: Practical guidelines and insights from four countries. Matern Child Nutr 2020;16(4):e13042. doi : 10.1111/mcn.13042.
- Widström AM, Brimdyr K, Svensson K, Cadwell K, Nissen E. Skin-to-skin contact the first hour after birth, underlying implications and clinical practice. Acta Paediatr 2019;108(7):1192-1204. doi : 10.1111/apa.14754.
- Widström AM, Brimdyr K, Svensson K, Cadwell K, Nissen E. A plausible pathway of imprinted behaviors: Skin-to-skin actions of the newborn immediately after birth follow the order of fetal development and intrauterine training of movements. Med Hypotheses 2020;134:109432. doi : 10.1016/j.mehy.2019.109432.
- Hubbard JM, Gattman KR. Parent-infant skin-to-skin contact following birth: History, benefits, and challenges. Neonatal Netw 2017;36(2):89-97. doi : 10.1891/0730-0832.36.2.89.
- Agence de la santé publique du Canada. Chapitre 6 : L’allaitement maternel : Les soins à la mère et au nouveau-né dans une perspective familiale : lignes directrices nationales. 2019. (consulté le 19 juillet 2023).
- Tomlinson C, Haiek LN; comité de nutrition et de gastroentérologie de la SCP. L’allaitement et le lait humain en soins intensifs néonatals : de la naissance jusqu’au congé. Le 6 juin 2023.
- Conde-Agudelo A, Díaz-Rossello JL. Kangaroo mother care to reduce morbidity and mortality in low birthweight infants. Cochrane Database Syst Rev 2016;2016(8):CD002771. doi : 10.1002/14651858.CD002771.pub4.
- Oras P, Thernström Blomqvist Y, Hedberg Nyqvist K et coll. Skin-to-skin contact is associated with earlier breastfeeding attainment in preterm infants. Acta Paediatr 2016;105(7):783-9. doi : 10.1111/apa.13431.
- Groupe d’étude de la méthode immédiate « mère kangourou » de l’OMS; Arya S, Naburi H et coll. Immediate “Kangaroo Mother Care” and survival of infants with low birth weight. N Engl J Med 2021;384(21): 2028-38. doi : 10.1056/NEJMoa2026486.
- Gupta N, Deierl A, Hills E, Banerjee J. Systematic review confirmed the benefits of early skin-to-skin contact but highlighted lack of studies on very and extremely preterm infants. Acta Paediatr 2021;110(8):2310-15. doi : 10.1111/apa.15913.
- Nyqvist KH, Expert Group of the International Network on Kangaroo Mother Care, Anderson GC et coll. State of the art and recommendations. Kangaroo mother care: Application in a high-tech environment. Breastfeed Rev 2010;99(6):812-29. doi : 10.1111/j.1651-2227.2010.01794.x.
- Montealegre-Pomar A, Bohorquez A, Charpak N. Systematic review and meta-analysis suggest that Kangaroo position protects against apnoea of prematurity. Acta Paediatr 2020;109(7): 310-16. doi : 10.1111/apa.15161.
- Aguilar-Lopez M, Dinsmoor AM, Ho TTB, Donovan SM. A systematic review of the factors influencing microbial colonization of the preterm infant gut. Gut Microbes 2021;13(1):1-33. doi : 10.1080/19490976.2021.1884514.
- Hendricks-Muñoz KD, Xu J, Parikh HI et coll. Skin-to-skin care and the development of the preterm infant oral microbiome. Am J Perinatol 2015;32(13):1205-16. doi : 10.1055/s-0035-1552941.
- Abouelfettoh A, Ludington-Hoe SM, Burant CJ, Visscher MO. Effect of skin-to-skin contact on preterm infant skin barrier function and hospital-acquired infection. J Clin Med Res 2011;3(1):36-46. doi : 10.4021/jocmr479w.
- Stewart CJ, Marrs ECL, Nelson A et coll. Development of the preterm gut microbiome in twins at risk of necrotising enterocolitis and sepsis. PLoS One 2013;8(8):e73465. doi : 10.1371/journal.pone.0073465.
- Johnston C, Campbell-Yeo M, Disher T et coll. Skin-to-skin care for procedural pain in neonates. Cochrane Database Syst Rev 2017;2(2):CD008435. doi : 10.1002/14651858.CD008435.pub3.
- Disher T, Benoit B, Johnston C, Campbell-Yeo M. Skin-to-skin contact for procedural pain in neonates: Acceptability of novel systematic review synthesis methods and GRADEing of the evidence. J Adv Nurs 2017;73(2):504-19. doi : 10.1111/jan.13182.
- Ionio C, Ciuffo G, Landoni M. Parent-infant skin-to-skin contact and stress regulation: A systematic review of the literature. Int J Environ Res Public Health 2021;18(9):4695. doi : 10.3390/ijerph18094695.
- Cañadas CD, Bonillo Perales A, Galera Martínez R, Casado-Belmonte MDP, Parrón Carreño T. Effects of kangaroo mother care in the NICU on the physiological stress parameters of premature infants: A meta-analysis of RCTs. Int J Environ Res Public Health 2022;19(1):583. doi : 10.3390/ijerph19010583.
- Pados BF, Hess F. Systematic review of the effects of skin-to-skin care on short-term physiologic stress outcomes in preterm infants in the neonatal intensive care unit. Adv Neonatal Care 2020;20(1):48-58. doi : 10.1097/ANC.0000000000000596.
- Adams-Chapman I, Heyne RJ, DeMauro SB et coll. Neurodevelopmental impairment among extremely preterm infants in the Neonatal Research Network. Pediatrics 2018;141(5):e20173091. doi : 10.1542/peds.2017-3091.
- Brummelte S, Grunau RE, Zaidman-Zait A, Weinberg J, Nordstokke D, Cepeda IL. Cortisol levels in relation to maternal interaction and child internalizing behavior in preterm and full-term children at 18 months corrected age. Dev Psychobiol 2011;53(2):184-95. doi : 10.1002/dev.20511.
- Kommers D, Oei G, Chen W, Feijs L, Bambang Oetomo S. Suboptimal bonding impairs hormonal, epigenetic and neuronal development in preterm infants, but these impairments can be reversed. Acta Paediatr 2016;105(7):738-51. doi : 10.1111/apa.13254.
- Vinall J, Grunau RE. Impact of repeated procedural pain-related stress in infants born very preterm. Pediatr Res 2014;75(5):584-87. doi : 10.1038/pr.2014.16.
- Ludington-Hoe SM, Johnson MW, Morgan K et coll. Neurophysiologic assessment of neonatal sleep organization: Preliminary results of a randomized, controlled trial of skin contact with preterm infants. Pediatrics 2006;117(5):e909-23. doi : 10.1542/peds.2004-1422.
- Wang Y, Zhao T, Zhang Y, Li S, Cong X. Positive effects of kangaroo mother care on long-term breastfeeding rates, growth, and neurodevelopment in preterm infants. Breastfeed Med 2021;16(4):282-91. doi : 10.1089/bfm.2020.0358.
- Charpak N, Montealegre-Pomar A, Bohorquez A. Systematic review and meta-analysis suggest that the duration of kangaroo mother care has a direct impact on neonatal growth. Acta Paediatr 2021;110(1):45-59. doi : 10.1111/apa.15489.
- Filippa M, Lordier L, De Almeida JS et coll. Early vocal contact and music in the NICU: New insights into preventive interventions. Pediatr Res 2020;87(2):249-64. doi : 10.1038/s41390-019-0490-9.
- Buil A, Sankey C, Caeymaex L, Apter G, Gratier M, Devouche E. Fostering mother-very preterm infant communication during skin-to-skin contact through a modified positioning. Early Hum Dev 2020;141:104939. doi : 10.1016/j.earlhumdev.2019.104939.
- Williams RC; groupe de travail de la petite enfance de la SCP. Des expériences négatives de l’enfance à la santé relationnelle précoce : les conséquences pour la pratique clinique. Le 3 avril 2023. https://cps.ca/fr/documents/position/des-experiences-negatives-de-lenfance-a-la-sante-relationnelle-precoce-les-consequences-pour-la-pratique-clinique.
- Bystrova K, Ivanova V, Edhborg M et coll. Early contact versus separation: Effects on mother-infant interaction one year later. Birth 2009;36(2):97-109. doi : 10.1111/j.1523-536X.2009.00307.x.
- Feldman R, Rosenthal Z, Eidelman AI. Maternal-preterm skin-to-skin contact enhances child physiologic organization and cognitive control across the first 10 years of life. Biol Psychiatry 2014;75(1):56-64. doi : 10.1016/j.biopsych.2013.08.012.
- Scatliffe N, Casavant S, Vittner D, Cong X. Oxytocin and early parent-infant interactions: A systematic review. Int J Nurs Sci 2019;6(4):445-53. doi : 10.1016/j.ijnss.2019.09.009.
- Gouvernement de Nouvelle-Galles du Sud. NSW Health. Clinical Guidelines for the Management of Substance Use During Pregnancy, Birth and the Postnatal Period. Sydney, Australie : NSW Health, 2014. (consulté le 19 juillet 2023).
- Cong S, Wang R, Fan X et coll. Skin-to-skin contact to improve premature mothers’ anxiety and stress state: A meta-analysis. Matern Child Nutr 2021;17(4):e13245. doi : 10.1111/mcn.13245.
- Wiberg B, Humble K, de Château P. Long-term effect on mother-infant behaviour of extra contact during the first hour post partum. V. Follow-up at three years. Scand J Soc Med 1989;17(2):181-91. doi: 10.1177/140349488901700209.
- Kirca N, Adibelli D. Effects of mother-infant skin-to-skin contact on postpartum depression: A systematic review. Perspect Psychiatr Care 2021;57(4):2014-23. doi : 10.1111/ppc.12727.
- Scime NV, Gavarkovs AG, Chaput KH. The effect of skin-to-skin care on postpartum depression among mothers of preterm or low birthweight infants: A systematic review and meta-analysis. J Affect Disord 2019;253: 376-84. doi : 10.1016/j.jad.2019.04.101.
- Filippa M, Saliba S, Esseily R, Gratier M, Grandjean D, Kuhn P. Systematic review shows the benefits of involving the fathers of preterm infants in early interventions in neonatal intensive care units. Acta Paediatr 2021;110(9):2509-20. doi : 10.1111/apa.15961.
- Bass JL, Gartley T, Lyczkowski DA, Kleinman R. Trends in the incidence of sudden unexpected infant death in the newborn: 1995-2014. J Pediatr 2018;196:104-08. doi : 10.1016/j.jpeds.2017.12.045.
- Rodriguez NA, Hageman JR, Pellerite M. Maternal distraction from smartphone use: A potential risk factor for sudden unexpected postnatal collapse of the newborn. J Pediatr 2018;200:298-99. doi : 10.1016/j.jpeds.2018.04.031.
- Feldman-Winter L, Goldsmith JP; comité d’étude du fœtus et du nouveau-né de l’AAP, groupe de travail sur la mort subite du nourrisson. Safe sleep and skin-to-skin care in the neonatal period for healthy term newborns. Pediatrics 2016;138(3):e20161889. doi : 10.1542/peds.2016-1889.
- Agence de la santé publique du Canada, Santé Canada, Société canadienne de pédiatrie, Institut canadien de la santé infantile, Fondation canadienne pour l’étude de la mortalité infantile. Énoncé conjoint sur le sommeil sécuritaire : prévenir les décès subits des nourrissons au Canada. https://www.phac-aspc.gc.ca/hp-ps/dca-dea/stages-etapes/childhood-enfance_0-2/sids/pdf/jsss-ecss2011-fra.pdf (consulté le 1er août 2023).
- Bartick M, Boisvert ME, Philipp BL, Feldman-Winter L. Trends in breastfeeding interventions, skin-to-skin care, and sudden infant death in the first 6 days after birth. J Pediatr 2020;218: 11-5. doi : 10.1016/j.jpeds.2019.09.069.
- American Academy of Pediatrics, Société canadienne de pédiatrie, American Heart Association. Manuel de réanimation néonatale, 8e éd. IOttawa, Ont. : SCP; 2022.
- Boulton JE, Coughlin K, O’Flaherty D, Solimano A, éd. L’ACoRN : Les soins aigus des nouveau-nés à risque, 2e éd. Ottawa, Ont. : Société canadienne de pédiatrie, 2021.
- B.C. Women’s Hospital/Health Centre, autorité sanitaire provinciale. Rooming‐in Guideline for Perinatal Women Using Substances. 2020:1-49. (consulté le 19 juillet 2023).
- National Institute on Drug Abuse (É.-U.). Words Matter – Terms to Use and Avoid When Talking about Addiction. Novembre 2021.(consulté le 2 août 2023).
- Bisanalli S, Nesargi S, Govindu RM, Rao SP. Kangaroo mother care in hospitalized low birth-weight infants on respiratory support: A feasibility and safety study. Adv Neonatal Care 2019;19(6):E21-5. doi : 10.1097/ANC.0000000000000666.
- Azevedo VM, Xavier CC, Gontijo Fde O. Safety of kangaroo mother care in intubated neonates under 1500 g. J Trop Pediatr 2012; 58(1):38-42. doi : 10.1093/tropej/fmr033.
- van Zanten HA, Havenaar AJ, Stigt HJH, Ligthart PAH, Walther FJ. The kangaroo method is safe for premature infants under 30 weeks of gestation during ventilatory support. J Neonatal Nursing 2007;13(5):186-90. doi : 10.1016/j.jnn.2007.07.002.
- Lorenz L, Dawson JA, Jones H et coll. Skin-to-skin care in preterm infants receiving respiratory support does not lead to physiological instability. Arch Dis Child-Fetal Neonatal Ed 2017;102(4):F339-44. doi : 10.1136/archdischild-2016-311752.
- Mori R, Khanna R, Pledge D, Nakayama T. Meta-analysis of physiological effects of skin-to-skin contact for newborns and mothers. Pediatr Int 2010;52(2):161-70. doi : 10.1111/j.1442-200X.2009.02909.x..
- Park HK, Choi BS, Lee SJ, Son IA, Seol IJ, Lee HJ. Practical application of kangaroo mother care in preterm infants: Clinical characteristics and safety of kangaroo mother care. J Perinat Med 2014;42(2):239-45. doi : 10.1515/jpm-2013-0066.
- Bera A, Ghosh J, Singh AK, Hazra A, Som T, Munian D. Effect of kangaroo mother care on vital physiological parameters of the low birth weight newborn. Indian J Community Med 2014;39(4):245-49. doi : 10.4103/0970-0218.143030.
- Heimann K, Vaessen P, Peschgens T, Stanzel S, Wenzl TG, Orlikowsky T. Impact of skin-to-skin care, prone and supine positioning on cardiorespiratory parameters and thermoregulation in premature infants. Neonatology 2010;97(4):311-17. doi : 10.1159/000255163.
- Bohnhorst B, Gill D, Dördelmann M, Peter CS, Poets CF. Bradycardia and desaturation during skin-to-skin care: No relationship to hyperthermia. J Pediatr 2004;145(4):499-502. doi : 10.1016/j.jpeds.2004.06.019.
- Bauer J, Sontheimer D, Fischer C, Linderkamp O. Metabolic rate and energy balance in very low birth weight infants during kangaroo holding by their mothers and fathers. J Pediatr 1996;129(4) 608-11. doi : 10.1016/s0022-3476(96)70129-4.
- Gale G, Franck L, Lund C. Skin-to-skin (kangaroo) holding of the intubated premature infant. Neonatal Netw 1993;12(6):49-57.
- Ludington-Hoe SM, Ferreira C, Swinth J, Ceccardi JJ. Safe criteria and procedure for kangaroo care with intubated preterm infants. J Obstet Gynecol Neonatal Nurs 2003;32(5) 579-88. doi : 10.1177/0884217503257618.
- Pandya D, Kartikeswar GAP, Patwardhan G, Kadam S, Pandit A, Patole S. Effect of early kangaroo mother care on time to full feeds in preterm infants – A prospective cohort study. Early Hum Dev 2021;154:105312. doi : 10.1016/j.earlhumdev.2021.105312.
- Broge MJ, Steurer LM, Ercole PM. The feasibility of kangaroo care and the effect on maternal attachment for neonates in a pediatric cardiac intensive care unit. Adv Neonatal Care 2021;21(3): E52-e59. doi : 10.1097/ANC.0000000000000800.
- Levesque V, Johnson K, McKenzie A, Nykipilo A, Taylor B, Joynt C. Implementing a skin-to-skin care and parent touch initiative in a tertiary cardiac and surgical neonatal intensive care unit. Adv Neonatal Care 2021;21(2):E24-34. doi : 10.1097/ANC.0000000000000770.
- DiMenna L. Considerations for implementation of a neonatal kangaroo care protocol. Neonatal Netw 2006;25(6):405-12. doi : 10.1891/0730-0832.25.6.405.
- Roark TH, DePriest D, Moore B et coll. Standardizing a method to safely perform kangaroo care for neonates while on high-frequency jet ventilation. Resp Care 2019;64(10):3235709 .
- Minot KL, Kramer KP, Butler C et coll. Increasing early skin-to-skin in extremely low birth weight infants. Neonatal Netw 2021;40(4):242-50. doi : 10.1891/11-T-749.
- Galligan M. Proposed guidelines for skin-to-skin treatment of neonatal hypothermia. MCN Am J Matern Child Nurs 2006;31(5):298-304,quiz 305-06. doi : 10.1097/00005721-200609000-00007.
- Craig A, Deerwester K, Fox L, Jacobs J, Evans S. Maternal holding during therapeutic hypothermia for infants with neonatal encephalopathy is feasible. Acta Paediatr 2019;108(9):1597-1602. doi : 10.1111/apa.14743.
- Saptaputra SK, Kurniawidjaja M, Susilowati IH, Pratomo H. How to improve the effectiveness and efficiency of kangaroo mother care: A literature review of equipment supporting continuous kangaroo mother care. Gac Sanit 2021;35(Suppl1):S98-s102. doi : 10.1016/j.gaceta.2020.12.037.
- Bollag L, Lim G, Sultan P et coll. Society for Obstetric Anesthesia and Perinatology: Consensus statement and recommendations for enhanced recovery after cesarean. Anesth Analg 2021;132(5):1362-77. doi : 10.1213/ANE.0000000000005257.
- Weber A, Jackson Y. A survey of neonatal clinicians’ use, needs, and preferences for kangaroo care devices. Adv Neonatal Care 2021;21(3):232-41. doi : 10.1097/ANC.0000000000000790
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.
Mise à jour : le 17 janvier 2024

Cliquez sur l’image pour l’agrandir