Point de pratique

Les soins aux enfants et aux adolescents ayant la paralysie cérébrale (aux niveaux III à V du GMFCS)
Affichage : le 29 septembre 2023
Auteur(s) principal(aux)
Scott McLeod, MD, FRCPC; Amber Makino, MD, FRCPC; Anne Kawamura, MD, FRCPC, Section de la pédiatrie du développement
Résumé
La paralysie cérébrale (PC) est l’incapacité physique la plus fréquente chez les enfants canadiens. Les soins complets des enfants ayant la PC, qui sont capables de marcher et qui fonctionnent aux niveaux I et II du système de classification de la fonction motrice globale (GMFCS) sont déjà exposés dans un point de pratique. Le présent document complémentaire traite des soins aux enfants ayant la PC qui fonctionnent aux niveaux III à V du GMFCS. Ceux qui fonctionnent aux niveaux III et IV du GMFCS utilisent des dispositifs d’assistance comme des déambulateurs, des cannes ou d’aides à la mobilité motorisées, tandis que ceux qui fonctionnent au niveau V du GMFCS ont besoin d’assistance à la mobilité comme un fauteuil roulant manuel. Le présent document contient un aperçu des principaux concepts relatifs à la détection précoce, aux services de réadaptation et aux possibilités de traitement pour les enfants présentant ces niveaux de PC, conjointement avec des ressources pratiques pour contribuer à la surveillance de la santé assurée par les pédiatres qui s’occupent de cette population.
Mots-clés : conseils préventifs; détection précoce; paralysie cérébrale; surveillance
Le diagnostic précoce et le pronostic moteur
Il est souvent possible de poser un diagnostic précis de paralysie cérébrale (PC) chez les nourrissons, d’après une combinaison d’observations obtenues à l’aide d’un outil d’examen physique (p. ex., notamment l’examen neurologique du nouveau-né Hammersmith [HINE]) et de l’imagerie par résonance magnétique[1]. Ce genre d’examens permet également de prédire le sous-type de PC et la future capacité d’ambulation[1]. Les nouveau-nés à risque, tels que les prématurés et ceux qui présentent une encéphalopathie hypoxo-ischémique, devraient faire l’objet d’une surveillance étroite dans le cadre du programme de suivi néonatal. Un diagnostic précis de PC peut être prédit avant l’âge de six mois chez ces nouveau-nés à risque à partir d’une évaluation du fonctionnement moteur (p. ex., l’évaluation des mouvements généraux de Prechtl) combinée aux résultats de l’HINE et de l’imagerie par résonance magnétique[1].
Les directives recommandent une intervention précoce, constituée d’un entraînement moteur axé sur les tâches chez les nourrissons ayant la PC (ou à haut risque de l’avoir), afin de stimuler la neuroplasticité et d’améliorer le fonctionnement moteur et cognitif à long terme[2]. La détection précoce et l’orientation rapide vers des services d’intervention contribueront au bien-être des proches aidants[1]. Dans la mesure du possible, les interventions devraient avoir lieu dans un environnement naturel, comme la maison de l’enfant, avec l’aide des proches, afin d’adapter les traitements à la tolérance du nourrisson, à ses besoins et aux objectifs de la famille[1].
Une fois le diagnostic posé, les parents demandent souvent aux pédiatres quelles seront les futures capacités de leur enfant. À l’âge de deux ans, il est possible d’établir la trajectoire de la motricité globale, et le système de classification de la fonction motrice globale (GMFCS) est utile pour prédire le pronostic moteur[3]. Il est rare qu’un nourrisson se hisse ou s’abaisse de plus d’un niveau du GFMCS[4], et à l’âge de cinq ans, l’enfant a terminé la majeure partie de son développement moteur[5]. Malgré tout, les pédiatres devraient encourager les enfants ayant une PC à acquérir une mobilité autonome adaptée et promouvoir leur participation à des activités motrices tout au long de leur vie[5].
Lors de tous les échanges sur le pronostic de l’enfant, il est important d’adopter une démarche fondée sur les forces et de se concentrer sur l’autonomie et les habiletés de l’enfant (plutôt que sur ses limites). Les formulations positives sont à privilégier. Par exemple : « Nous allons nous efforcer d’aider votre enfant à se déplacer de manière autonome, ce qui peut inclure une aide à la mobilité comme un déambulateur » ou « Pour favoriser son développement global, il est très important d’encourager l’enfant à explorer le monde qui l’entoure et à se déplacer quand et où il le désire, avec la plus grande autonomie possible » sera accueilli de manière beaucoup plus positive que « Votre enfant ne pourra jamais marcher seul ». Il est capital d’entretenir l’espoir et de conserver une perspective optimiste tout en gérant les attentes des parents, afin de cultiver la relation avec la famille et de la soutenir tout au long de la trajectoire de l’enfant.
La « maison » pour optimiser le développement et la réadaptation
Les pédiatres sont d’importants points de contact pour les enfants, les adolescents et les familles qui cherchent à obtenir des conseils sur les possibilités de traitement de la PC. Des ressources pratiques comme State of the evidence traffic lights (feux de signalisation sur l’état des données probantes), qui est en constante mise à jour et fournit une analyse détaillée des interventions relatives à la PC, peuvent aider les pédiatres à se familiariser avec les possibilités de traitement et à mettre à jour leurs connaissances sur le sujet. Au moyen d’un diagramme à bulles, l’outil propose des indicateurs visuels sur la qualité des données probantes relatives à une série de possibilités de traitement[6].
Les directives actuelles en matière de réadaptation pédiatrique favorisent l’adoption précoce de thérapies orientées sur les objectifs et fondée sur les activités[7] plutôt que des stratégies plus passives (que les enfants reçoivent) qui visent à normaliser le mouvement par une stimulation motrice non spécifique. Les objectifs thérapeutiques sont axés sur la pratique active de tâches de la vie quotidienne (p. ex., marcher à l’aide d’un déambulateur, faire du vélo adapté, manger avec une cuiller), importantes pour l’enfant et la famille. Le GMFCS peut contribuer à s’assurer que les objectifs sont liés aux capacités fonctionnelles. Par exemple, un enfant qui fonctionne au niveau IV du GMFCS peut apprendre à activer son fauteuil roulant électrique plutôt qu’à marcher. Le clinicien qui s’informe de ce que l’enfant et les proches aidants font pour s’amuser peut lancer une conversation sur l’adaptation des activités pour promouvoir la participation et la forme physique (p. ex., hockey sur luge, ski en fauteuil, vélo adapté). Les ludothérapeutes peuvent trouver et proposer des activités récréatives stimulantes qu’aime l’enfant, qui donnent un répit aux parents et qui favorisent la participation communautaire. La programmation varie énormément selon le lieu, si bien que les conversations et les propositions dépendront des ressources locales.
La communication est une habileté essentielle pour tous les enfants. Certains enfants ayant la PC présentent une dysarthrie, qui rend la communication orale difficile. Des méthodes de communication améliorée et alternative (CAA) peuvent développer au maximum la capacité à communiquer et ainsi soutenir l’inclusion, la socialisation et l’apprentissage. Une consultation spécialisée est requise pour trouver les méthodes les mieux adaptées à chaque enfant, ce qui peut dépendre de facteurs comme la dextérité manuelle, la cognition et la vision. Les possibilités varient entre l’enseignement du langage des signes ou l’utilisation de pictogrammes réunis dans un livre d’assistance et un système de synthèse vocale ou la technologie de la fixation du regard qui peut être installée sur des aides à la mobilité pour que l’enfant ait accès à tous les lieux où il souhaite se rendre.
Des évaluations psychoéducatives sont essentielles pour s’assurer que les milieux de garde, les services scolaires et les autres milieux d’apprentissage sont adaptés pour soutenir les forces et les besoins de l’enfant. Puisque le financement est souvent limité pour la tenue de telles évaluations, il sera peut-être nécessaire d’opter pour une communication et une consultation entre l’école et un pédopsychologue pour déterminer le meilleur moment d’effectuer une évaluation en fonction de l’âge et de la phase de développement de l’enfant.
L’équipement auxiliaire
Puisque la subluxation de la hanche est courante chez les enfants qui fonctionnent aux niveaux III à V du GMFCS, il est important de leur donner accès à des verticalisateurs pour promouvoir les activités de mise en charge. Les orthèses cheville-pied, les attelles d’extension du genou et les attelles de la main en position de repos contribuent à prévenir les contractures musculaires qui peuvent compromettre le confort et le fonctionnement quotidien. Pour éviter les chutes, favoriser l’accessibilité au maximum et accroître l’autonomie et la facilité des soins, il est possible d’installer des meubles ou des dispositifs d’assistance à la maison, tels que des barres d’appui, des chaises de bain ou des bancs de douche, des plans inclinés et des plateformes élévatrices. Ces aménagements peuvent également alléger le fardeau des proches aidants. Une orientation en ergothérapie pour procéder à une analyse de la sécurité du domicile et de l’équipement à privilégier peut se révéler inestimable.
La surveillance de la santé
L’accès à une « maison médicale » (medical home) stable pour les enfants et les adolescents ayant la PC contribue à établir et à renforcer des relations à long terme entre les dispensateurs de soins primaires en pédiatrie, les jeunes qui les consultent et les familles. Dans toutes les familles, il peut être plus difficile de maintenir les relations interpersonnelles, le fonctionnement et le bien-être pendant les périodes de transition ou de stress. L’exploration des déterminants sociaux de la santé et les mesures pour les atténuer lorsque la famille est aux prises avec des inégalités ainsi que les dispositions pour l’aider à s’y retrouver dans les divers systèmes, à accéder à du counseling ou à obtenir des soins de répit et d’autres services peuvent avoir de profondes répercussions sur le bien-être de l’enfant et sa famille.
Les stratégies de réadaptation sont le pilier de la prise en charge de la PC, mais lorsque l’hypertonie est source de douleurs, compromet les soins (p. ex., habillage ou hygiène) ou limite la participation, d’autres traitements s’imposent. Une orientation personnalisée vers un centre de réadaptation ou un thérapeute expérimenté en hypertonie peut être nécessaire. Il est fréquent d’utiliser des médicaments par voie orale qui ont l’effet généralisé de réduire le tonus musculaire. Le baclofène par voie orale est un traitement de première ligne contre la spasticité et la dystonie généralisées chez les enfants qui ont la PC. La constipation et la sédation en sont des effets secondaires fréquents. Les familles devraient être informées de ne pas mettre soudainement un terme au baclofène, sous peine de provoquer une hypertonie de rebond. Lorsqu’une hypertonie focale (dans des muscles ou des groupes de muscles précis) provoque de la douleur, compromet les soins ou nuit au fonctionnement, on peut envisager l’administration périodique d’injections de toxine botulinique A. Une trajectoire de soins fondée sur des données probantes pour aider les cliniciens à traiter la dystonie chez les enfants ayant la PC est proposée en ligne.
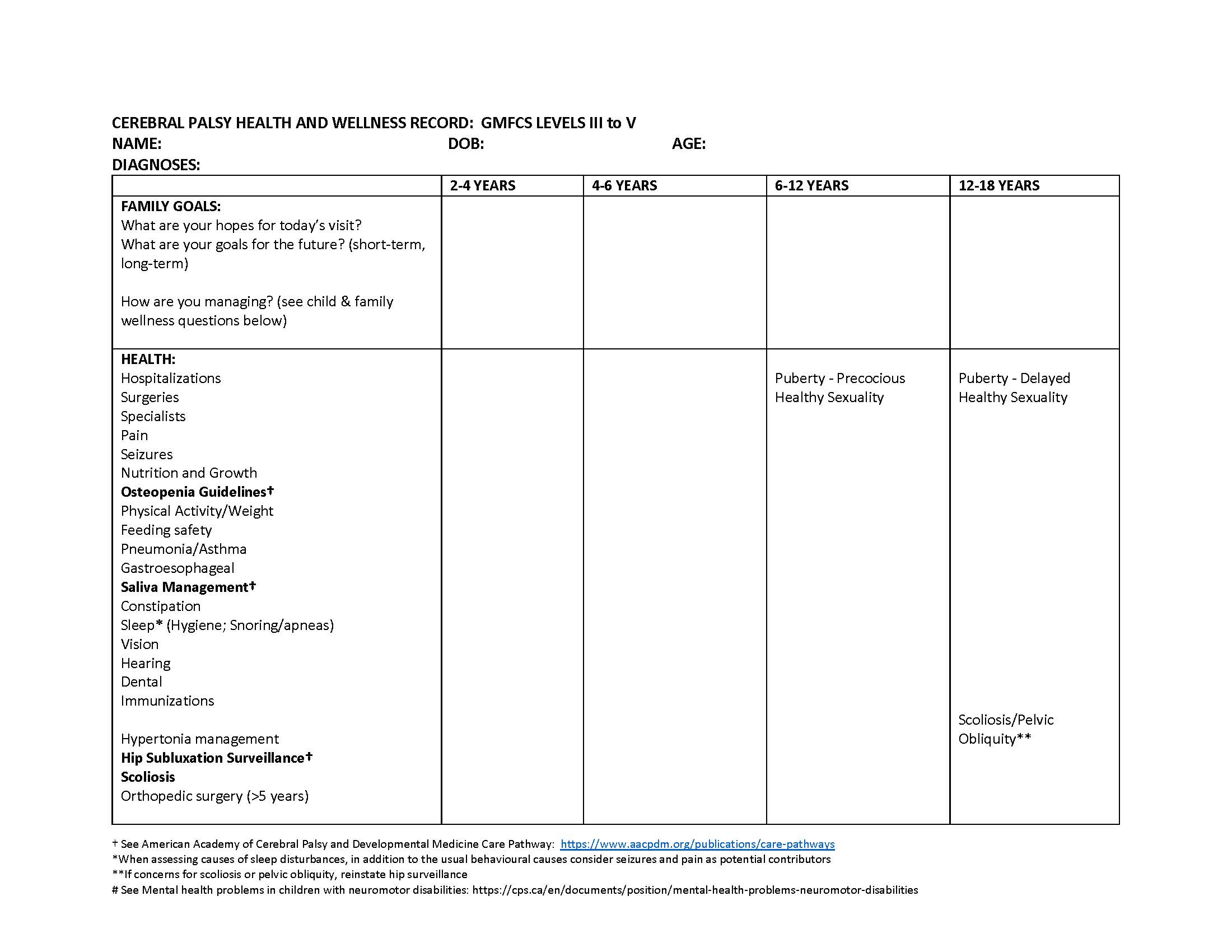
Une approche systématique de la surveillance de la santé peut aider les enfants ayant une PC qui fonctionnent aux niveaux III à V du GMFCS (figure 1). L’efficacité de trajectoires de soins fondées sur des données probantes qui peuvent contribuer à la surveillance et au traitement de la subluxation de la hanche, de l’ostéoporose et de la sialorrhée est démontrée. La surveillance de la subluxation de la hanche au moyen d’un examen physique et d’une radiographie antéropostérieure du bassin devrait généralement être prévue tous les six à 12 mois auprès des enfants ayant la PC, qui sont plus à risque. La détection précoce de la migration de la hanche chez les enfants qui font peu de mise en charge (niveaux III à V du GMFCS) peut favoriser des interventions orthopédiques rapides[8]. L’orientation en orthopédie est généralement recommandée lorsque l’imagerie démontre que plus de 30 % de la tête fémorale est excentrée du bassin, parce qu’il faudra peut-être procéder à une libération des tissus mous ou à une chirurgie reconstructive de la hanche pour prévenir une luxation de la hanche et la douleur chronique[8].
Il est capital de promouvoir la santé osseuse par la prise régulière de suppléments de vitamine D, de s’assurer d’un apport nutritionnel suffisant de calcium et de prévoir des activités régulières de mise en charge ou de mise en charge assistée. L’évaluation régulière de l’état nutritionnel et des troubles de déglutition reposant sur une anamnèse attentive et sur des analyses de la déglutition par vidéofluoroscopie, au besoin, peut influer sur le counseling relatif à l’apport nutritionnel et à une alimentation sécuritaire. La position assise pendant l’alimentation, un rythme d’alimentation adapté et l’épaississement des liquides peuvent contribuer à éviter l’aspiration d’aliments, l’une des principales raisons pour lesquelles les enfants ayant la PC sont hospitalisés.
Les possibilités chirurgicales
Les possibilités neurochirurgicales peuvent être envisagées dans les situations où les traitements de première ligne échouent et où l’hypertonie continue de nuire aux capacités fonctionnelles ou à la qualité de vie de l’enfant. Puisque les enfants et les adolescents ayant la PC ont besoin d’une prise en charge spécialisée assurée par une équipe multidisciplinaire, il est souvent nécessaire de les orienter vers un centre de soins tertiaires.
La rhizotomie dorsale sélective est une intervention qui consiste à sectionner certaines radicelles nerveuses pour modifier les signaux sensoriels dans l’arc réflexe et ainsi réduire la spasticité. Pour qu’une telle intervention soit envisagée, le patient :
- doit être né avant terme et présenter des lésions caractéristiques de la substance blanche, telles que la leucomalacie périventriculaire,
- ne doit pas avoir de trouble des mouvements dyskinétiques,
- ne doit pas avoir de contractures musculosquelettiques,
- doit posséder une force musculaire antigravitaire, ou
- doit présenter des facteurs psychosociaux positifs (p. ex., il a accès à un programme thérapeutique auquel il peut participer)[9][10].
Les avantages de la rhizotomie dorsale sélective semblent plus marqués chez les personnes ayant une PC de niveau II ou III du GMFCS. Cette intervention est controversée chez les enfants qui fonctionnent aux niveaux IV et V du GMFCS, mais la performance des tâches liées à la motricité globale s’est améliorée chez certains de ceux qui y ont été soumis, et ces enfants ont même dépassé l’évolution naturelle escomptée[9].
Le traitement au baclofène intrathécal consiste à implanter par voie chirurgicale une pompe et un cathéter dans l’espace intrathécal. Il peut soigner la dystonie et la spasticité chez les personnes ayant la PC qui fonctionnent aux niveaux IV et V du GMFCS[11]. Les indications comprennent l’échec des médicaments par voie orale (p. ex., le baclofène) pour traiter l’hypertonie qui provoque des douleurs ou compromet la qualité de vie ou les activités de la vie quotidienne[11]. Le taux de complications est élevé, et le délogement du cathéter ou le dysfonctionnement de la pompe peut provoquer un grave sevrage du baclofène. Les personnes qui reçoivent un traitement au baclofène intrathécal doivent pouvoir accéder à des soins spécialisés d’urgence.
La stimulation cérébrale profonde est une forme de neuromodulation réservée aux enfants ayant une dystonie réfractaire grave et une atteinte fonctionnelle importante malgré une prise en charge appropriée, lorsqu’il est impossible d’opter pour d’autres possibilités de traitement[12]. Jusqu’à présent, les études qui portent sur ce type de stimulation chez les enfants ayant la PC sont de petite dimension, mais ont démontré des réductions marquées des symptômes liés à la douleur et des besoins en analgésiques[13].
Points de pratique exemplaires
Les enfants et les adolescents ayant la paralysie cérébrale (PC) aux niveaux III à V du système de classification de la fonction motrice globale (GMFCS) devraient profiter d’une « maison » pour optimiser leur développement et leur réadaptation et recevoir la surveillance et le suivi réguliers prévus pour la prise en charge des affections et des troubles de santé courants auprès de cette population. Les pédiatres sont en position idéale pour assurer le suivi, favoriser le bien-être et inciter les enfants et les familles qui vivent avec la PC à être les plus autonomes et dans la meilleure santé possible. Ils représentent également un point central pour communiquer avec les membres de l’équipe soignante, les autorités scolaires, les dispensateurs de soins hospitaliers et les services communautaires.
Les pédiatres et les autres dispensateurs de soins primaires devraient s’attacher à :
- favoriser un diagnostic précoce à l’aide d’outils fondés sur des données probantes comme l’examen neurologique du nouveau-né Hammersmith et l’imagerie par résonance magnétique pour pouvoir offrir rapidement des interventions et un accès à des services de soutien.
- explorer l’importance d’une réadaptation active et orientée par les objectifs avec les enfants et leur famille, axée sur le plaisir, la forme physique et l’amitié.
- assurer une surveillance et un soutien continus de la santé par le maintien d’un dossier de santé et de bien-être détaillé.
Figure 1. Fiche de santé et de bien-être des enfants ayant la paralysie cérébrale qui se situent aux niveaux III à V du GMFCS
Traduite en français ci-dessous. Cette fiche peut être imprimée et utilisée conjointement avec d’autres guides de promotion de la santé fondés sur des données probantes, tels que le Relevé postnatal Rourke et le Relevé médical Greig, afin de donner aux cliniciens un cadre pour explorer les secteurs de soins appropriés aux enfants ayant la PC qui se situent aux niveaux III à V du GMFCS.
|
ENFANT OU ADOLESCENT |
PROCHE AIDANT OU FAMILLE |
|
PARTICIPATION : plaisir ou forme physique
|
PARTICIPATION : plaisir ou forme physique
|
|
BIEN-ÊTRE EN SOCIÉTÉ : amis et famille
|
BIEN-ÊTRE EN SOCIÉTÉ : amis et famille
|
|
BIEN-ÊTRE AFFECTIF
|
BIEN-ÊTRE AFFECTIF
|
|
SOUTIEN ET OBSTACLES
|
|
Remerciements
Le comité de direction de la section des soins complexes, le comité de la pédiatrie communautaire et le comité de la santé mentale et des troubles du développement de la Société canadienne de pédiatrie ont révisé le présent point de pratique.
SECTION DE LA PÉDIATRIE DU DÉVELOPPEMENT DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE (2021-2022)
Membres : Sabrina Eliason MD (présidente); Alexandra Jackman MD; Jenna McWhirter BSCH, MD (représentante des résidents); Asha Nair MD; Jacqueline Ogilvie M. Sc., MD, FRCPC; Angela Orsino MD (secrétaire-trésorière); Iskra Peltekova MD; Melanie Penner MD (présidente sortante); Gurpreet (Preety) Salh MD, FRCPC (vice-présidente)
Auteurs principaux: Scott McLeod, MD, FRCPC; Amber Makino, MD, FRCPC; Anne Kawamura, MD, FRCPC
Références
- Novak I, Morgan C, Adde L et coll. Early, accurate diagnosis and early intervention in cerebral palsy: Advances in diagnosis and treatment. JAMA Pediatr 2017;171(9):897–907. doi : 10.1001/jamapediatrics.2017.1689.
- Morgan C, Fetters L, Adde L et coll. Early intervention for children aged 0 to 2 years with or at high risk of cerebral palsy: international clinical practice guideline based on systematic reviews. JAMA Pediatr 2021;175(8):846–58. doi : 10.1001/jamapediatrics.2021.0878.
- Rosenbaum PL, Palisano RJ, Bartlett DJ, Galuppi BE, Russell DJ. Development of the Gross Motor Function Classification System for cerebral palsy. Dev Med Child Neurol 2008;50(4):249–53.
- Palisano RJ, Cameron D, Rosenbaum PL, Walter SD, Russell D. Stability of the gross motor function classification system. Dev Med Child Neurol 2006;48(6):424–8. doi : 10.1017/S0012162206000934.
- Rosenbaum PL, Walter SD, Hanna SE et coll. Prognosis for gross motor function in cerebral palsy: Creation of motor development curves. JAMA 2002;288(11):1357–63. doi : 10.1001/jama.288.11.1357.
- Novak I, Morgan C, Fahey M et coll. State of the evidence traffic lights 2019: Systematic review of interventions for preventing and treating children with cerebral palsy. Curr Neurol Neurosci Rep 2020;20(2):3. doi : 10.1007/s11910-020-1022-z.
- Novak I. Evidence-based diagnosis, health care, and rehabilitation for children with cerebral palsy. J Child Neurol 2014;29(8):1141–56. doi : 10.1177/0883073814535503.
- American Academy of Cerebral Palsy and Developmental Medicine. Hip Surveillance in Cerebral Palsy. 2017. https://www.aacpdm.org/publications/care-pathways/hip-surveillance-in-cerebral-palsy (consulté le 31 mars 2023).
- Iorio-Morin C, Yap R, Dudley RWR et coll. Selective dorsal root rhizotomy for spastic cerebral palsy: A longitudinal case-control analysis of functional outcome. Neurosurgery 2020;87(2):186–92. doi : 10.1093/neuros/nyz422.
- Summers J, Coker B, Eddy S et coll. Selective dorsal rhizotomy in ambulant children with cerebral palsy: An observational cohort study. Lancet Child Adolesc Health 2019;3(7):455–62. doi : 10.1016/S2352-4642(19)30119-1.
- Bonouvrié LA, Becher JG, Vles JSH, Vermeulen RJ, Buizer AI; IDYS Study Group. The effect of intrathecal baclofen in dyskinetic cerebral palsy: The IDYS Trial. Ann Neurol 2019;86(1):79–90. doi : 10.1002/ana.25498.
- Sanger TD. Deep brain stimulation for cerebral palsy: Where are we now? Dev Med Child Neurol 2020;62(1):28–33. doi : 10.1111/dmcn.14295
- Perides S, Lin JP, Lee G et coll. Deep brain stimulation reduces pain in children with dystonia, including in dyskinetic cerebral palsy. Dev Med Child Neurol 2020;62(8):917–25. doi : 10.1111/dmcn.14555.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.
Mise à jour : le 9 février 2024