Point de pratique

La saturométrie pour mieux dépister la cardiopathie congénitale grave chez les nouveau-nés
Affichage : le 27 novembre 2017 | Reconduit : le 24 février 2023
Auteur(s) principal(aux)
Michael Narvey, Kenny Wong, Anne Fournier, Comité d’étude du fœtus et du nouveau-né
Paediatrics & Child Health, 22(8):499–503 
Résumé
La saturométrie est un moyen simple, sécuritaire, non invasif et démontré d’améliorer le dépistage de la cardiopathie congénitale grave chez les nouveau-nés. Pourtant, ce test n’est pas encore utilisé systématiquement au Canada. Le présent point de pratique fait ressortir l’information essentielle et les recommandations en matière de dépistage. Selon les recherches, la saturométrie de dépistage est hautement spécifique et comporte un faible taux de résultats faussement positifs. Le dépistage optimal de la cardiopathie congénitale grave devrait inclure une échographie prénatale, un examen physique et une saturométrie. Celle-ci devrait être effectuée de 24 à 36 heures après la naissance, à la main droite et l’un des deux pieds du nouveau-né, afin de réduire au minimum le nombre de résultats faussement positifs. Si les résultats sont anormaux, le dispensateur de soins qui a la plus grande responsabilité du nouveau-né doit le soumettre à une évaluation approfondie. Dans l’impossibilité d’exclure un diagnostic de trouble cardiaque, il est recommandé d’orienter le nouveau-né vers un cardiologue pédiatre et de lui faire subir une échocardiographie.
Mots-clés : CCHD; NICU; POS
Il est démontré que la saturométrie améliore le dépistage de cardiopathie congénitale grave (CPCG) chez le nouveau-né [1]–[4]. De nombreux programmes dans le monde ont recommandé et adopté la saturométrie de dépistage (SdD), mais celle-ci n’est pas encore une pratique standard au Canada. Le présent point de pratique expose les faits saillants et les recommandations d’un document de principes que la Société canadienne de cardiologie et l’Association canadienne de cardiologie pédiatrique ont récemment publié et qui est cautionné par la Société cana dienne de pédiatrie [5]. Dans le présent point de pratique, le terme « nouveau-né » désigne les nouveau-nés à terme ou peu prématurés (de 340/7 à 366/7 semaines d’âge gestationnel) traités hors de l’unité de soins intensifs néonatals (USIN).
QU’EST-CE QUE LA CARDIOPATHIE CONGÉNITALE GRAVE?
La cardiopathie congénitale (CPC) est la malformation congénitale la plus répandue, avec une prévalence de 12 cas sur 1000 naissances vivantes au Canada. Environ le quart de ces nouveau-nés sont atteints d’une CPCG, définie par des lésions plus graves, souvent canal-dépendantes, qui requièrent une intervention en début de vie pour profiter d’un pronostic optimal (encadré 1) [3][6][7].
POURQUOI DEVONS-NOUS EN FAIRE PLUS?
Il demeure essentiel de diagnostiquer les CPCG rapidement, car si on tarde, la morbidité, la mortalité et les incapacités s’aggravent [7]. Selon une étude réalisée aux États-Unis, 30 % des cas de CPCG sont diagnostiqués plus de trois jours après la naissance, alors qu’une étude du nord de l’Angleterre signale que 25 % des cas de CPCG sont diagnostiqués après leur congé de l’hôpital [8][9]. Dans une étude effectuée en Suède, 4,6 décès sur 100000 naissances vivantes sont attribuables à une CPCG non dépistée [10]. Par ailleurs, un sondage ponctuel du Programme canadien de surveillance pédiatrique (PCSP) a révélé que 36 % des répondants avaient été témoins de CPCG à présentation tardive, et que 52 % d’entre eux se rappelaient que ces cas avaient exigé une réanimation [11].
|
Encadré 1. Exemples de lésions qui peuvent être dépistées par saturométrie Lésions habituellement accompagnées de cyanose Hypoplasie du cœur gauche Atrésie pulmonaire à septum interventriculaire intact Retour veineux pulmonaire anormal total Tétralogie de Fallot Transposition des gros vaisseaux Atrésie tricuspide Tronc artériel Lésions parfois accompagnées de cyanose Coarctation de l’aorte Ventricule droit à double issue Anomalie d’Ebstein Arc aortique interrompu Malformations caractérisées par la présence d’un seul ventricule fonctionnel (cœur univentriculaire) Traduit et adapté de la référence 3 |
La faible sensibilité de l’échographie prénatale en limite l’utilité en matière de dépistage. Entre 2007 et 2010, seulement 50 % des nouveau-nés de l’Alberta qui ont dû être opérés avant l’âge d’un an à cause d’une CPC avaient été diagnostiqués avant la naissance. Ce taux de dépistage était semblable à ceux obtenus dans de vastes études menées aux États-Unis et au Royaume-Uni. Dans l’ensemble, le taux de dépistage s’améliore, mais il dépend des compétences régionales et d’autres facteurs médiateurs [9][12][13].
Il se peut que l’examen physique donne des résultats limités parce que les examinateurs manquent d’expertise ou de confiance en eux. De plus, avant le congé, certains types de CPCG ne présentent pas de caractéristiques cliniques, sous forme de souffle, de cyanose, de tachypnée ou de respiration laborieuse, par exemple [3]. D’après une étude de la Norvège, celles-ci ne permettaient de déceler que 77 % des CPCG avant le congé dans les hôpitaux sans SdD [1].
EN QUOI LA SdD EST-ELLE UTILE?
La SdD peut dépister des degrés de cyanose autrement indécelables en clinique. C’est pourquoi il faudrait l’ajouter à l’échographie prénatale et à l’examen physique du nouveau-né pour réduire les lacunes liées au diagnostic de CPCG [14]. Dans une vaste étude multicentrique réalisée en Suède, les hôpitaux ont déclaré que la SdD avait une valeur prédictive positive sept fois plus élevée que l’examen physique (20,69 % comparativement à 3,06 %) et un rapport de vraisemblance beaucoup plus élevé pour déceler la CPCG (344,8 par rapport à 32,4) [10]. Grâce à l’ajout de la SdD à l’échographie prénatale et à l’examen physique du nouveau-né, la sensibilité atteint de 82 % à 92 % [10][15].
En extrapolant les résultats d’une étude [15] qui démontraient un taux de détection prénatale de 50 % chez les enfants présentant une CPCG, la SdD pourrait déceler 35 nouveau-nés supplémentaires ayant ces anomalies cardiaques sur 100000 nais- sances. Au Canada, où 388 729 naissances ont été recensées en 2014, si on calcule une incidence de trois cas de CPCG sur 1000 naissances et un taux de détection prénatale de 50 %, 583 cas de CPCG devraient être dépistés après la naissance. L’adoption de la SdD pourrait permettre de déceler 136 cas de CPCG supplémentaires par année, avant même l’apparition de symptômes. Le sondage du PCSP a établi que 83 % des pédia tres généraux répondants connaissaient la SdD, mais que seulement 20 % l’utilisaient [11].
QUELLE EST LA VALEUR DE LA SdD COMME TEST DE DÉPISTAGE?
La SdD est une intervention sécuritaire, non invasive, facile à exécuter et largement accessible. Dans une analyse systématique regroupant 229421 nouveau-nés, la spécificité élevée (99,9 %) et la sensibilité modérément élevée (76,5 %) de ce test ont été démontrées [4]. Des études en provenance des États-Unis et du Royaume-Uni indiquent également que la SdD n’a pas d’incidence ou a une incidence positive sur les coûts de dépistage des CPCG [10][16]–[18].
Les résultats anormaux de la SdD, et particulièrement ceux qui sont faussement positifs (FP), peuvent contribuer à déceler d’autres causes d’hypoxémie, y compris des infections et des troubles respiratoires graves qui nécessitent une intervention [19].
La portée potentielle de la SdD est comparable à celles de pratiques de dépistage plus établies chez le nouveau-né. En effet, les CPCG sont aussi courantes chez les nouveau-nés que la fibrose kystique (0,5 cas sur 1000 naissances), le déficit auditif (un à trois cas sur 1000) et l’hypothyroïdie (un cas sur 4000). De plus, les résultats FP de la SdD (entre 0,05 % et 0,5 %) sont semblables à ceux du dépistage universel des troubles de l’audition chez les nouveau-nés (0,5 % à 4 %) et des troubles thyroïdiens chez les nouveau-nés (2 %), sinon plus faibles [20].
QUI DEVRAIT ÊTRE SOUMIS AU DÉPISTAGE?
Tous les nouveau-nés qui sont à terme ou peu prématurés devraient être systématiquement soumis au dépistage. La SdD n’a pas fait l’objet d’études convenables chez les nouveau-nés prématurés ni à l’USIN pour établir des valeurs seuils normales et anormales. La saturométrie est un mode de surveillance important chez les nouveau-nés présentant des signes de CPC, tels qu’un souffle cardiaque organique ou d’autres problèmes cardiaques, mais le protocole de SdD décrit dans le présent docu ment vise les nouveau-nés asymptomatiques dans des milieux de soins non aigus.
QUAND LES NOUVEAU-NÉS DOIVENT-ILS SUBIR UN TEST DE DÉPISTAGE?
La SdD peut être exécutée en tout temps après la naissance, mais elle est recommandée chez les nouveau-nés âgés de 24 à 36 heures. Une méta-analyse a révélé des taux de dépistage FP de 0,05 % après l’âge de 24 heures (plutôt que de 0,50 % auparavant), sans répercussion significative sur la sensibilité [4]. Ce décuplement des résultats FP pourrait avoir des conséquences importantes sur l’utilisation des ressources, surtout lorsqu’il faut recourir aux services de transport pour avoir accès à des soins en cardiologie.
Le dépistage de 24 à 36 heures après la naissance apporte une certaine flexibilité. Ainsi, le test est intégré à l’horaire quotidien, mais n’a pas à être effectué à l’aube, alors qu’un résultat positif accroîtrait la charge de travail ou solliciterait des ressources inutilement. Certains centres procèdent à la SdD en même temps que le dépistage des troubles de l’audition, le premier bain ou d’autres évaluations systématiques. Il faudra prévoir des dispositions particulières pour assurer le dépistage des nouveau-nés dont la mère accouche à domicile ou qui obtiennent leur congé de l’hôpital ou d’un centre des naissances autonome avant l’âge de 24 heures. Malgré le risque plus élevé de résultats FP, il est préférable d’effectuer le dépistage dans les 24 premières heures que de l’omettre. Cette solution pourrait être efficace dans les centres où le système de soins est assez rigoureux pour garantir que les nouveau-nés ayant reçu leur congé rapidement reviennent ou soient évalués par une infirmière de la santé publique entre l’âge de 24 et 36 heures. De même, les sages-femmes pourraient effectuer le dépistage pendant la visite habituelle à domicile, environ 24 heures après la naissance. Quelles que soient les pratiques locales, il est essentiel de privilégier l’uniformité et des communications efficaces, ainsi que de se doter d’un système visant à éviter de perdre les nouveau- nés au suivi.
À la figure 1 est exposé le protocole préconisé dans le document de principes de la Société canadienne de cardiologie et de l’Association canadienne de cardiologie pédiatrique [5]. Le dépistage s’effectue en cinq minutes environ [17].
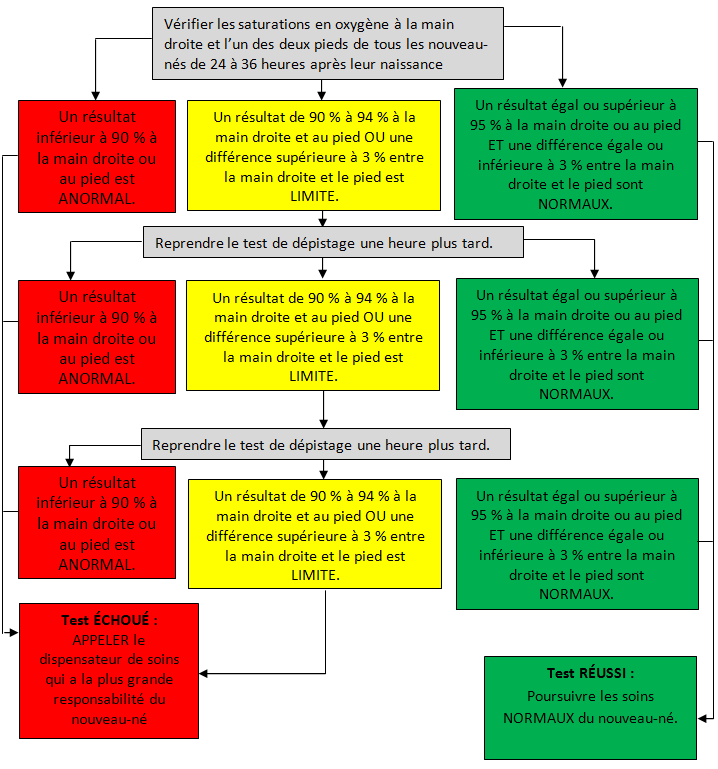
Les protocoles qui se limitent à un pied permettent de déceler la plupart des CPCG, mais la sensibilité est plus élevée lorsqu’on utilise la main droite et un pied. La main gauche n’est pas recommandée, en raison de la proximité du canal artériel. L’utilisation du matériel et les pratiques de saturométrie devraient dépendre des compétences locales.
Le seuil de saturation en oxygène (SaO2) de 90 % pour les échecs de dépistage est corroboré par les données d’une étude dans laquelle le groupe de CPCG présentait une SaO2 médiane post-canal de 90 % [10]. Un résultat limite du dépistage, lorsque la lecture de la SaO2 se situe entre 90 % et 94 % à l’un des membres ou que la différence entre les membres est supérieure à 3 %, est plus susceptible de constituer un résultat FP qu’une lecture de SaO2 inférieure à 90 %. Dans les études, le test était généralement répété au bout d’une heure afin de laisser opérer la circulation transitionnelle et de réduire le risque de résultat FP. Un troisième résultat limite est considéré comme un « échec », parce que la reprise constante du test rallonge inutilement le processus de dépistage, ce qui risque d’entraîner une décompensation clinique.
QUE FAIRE LORSQUE LA SdD ÉCHOUE?
Les nouveau-nés dont le test de dépistage échoue doivent subir une évaluation approfondie, effectuée par le dispensateur de soins qui a la plus grande responsabilité de l’enfant. Il peut s’agir d’une sage-femme, d’une infirmière, d’une infirmière praticienne ou d’un médecin. Il peut être utile de procéder à une évaluation qui comprend la tension artérielle aux quatre membres, une électrocardiographie et une radiographie pulmonaire. Si ce n’est pas déjà fait, il faut consulter un pédiatre, et lorsque la cause la plus probable d’échec du dépistage semble être d’origine cardia que ou demeure nébuleuse, une consultation en cardio logie pédiatrique, suivie d’une échocardiographie, s’impose pour exclure la CPCG. Dans bien des centres du Canada, l’importance de limiter les résultats FP est amplifiée par la nécessité de transporter le nouveau-né par voie terrestre ou aérienne pour lui donner accès aux services cardiologiques, y compris l’échocardiographie.
QUELLES SONT LES LIMITES DE LA SdD?
La SdD peut contribuer à dépister les anomalies cardiaques énumérées dans l’encadré 1, mais elle ne peut déceler tous les patients atteints d’une CPC. Le taux de résultats faussement négatifs est faible, puisque dans une méta-analyse, ce type de résultats n’est signalé que chez 33 cas sur 229421 nouveau-nés (0,014 %) soumis au dépistage [4]. Comme la coarctation de l’aorte est difficile à diagnostiquerindépendamment du mode de dépistage, il est essentiel de procéder à une évaluation fiable des pouls fémoraux pendant la période néonatale.
Il est difficile de généraliser l’efficience de la SdD dans toutes les régions du Canada, car le taux de dépistage par échographie prénatale et l’accès à l’échocardiographie varient beaucoup d’une région à l’autre. Toutefois, dans les régions où le taux de dépistage prénatal est élevé, la SdD comporterait probablement moins d’avantages.
SOMMAIRE DES RECOMMANDATIONS
- La saturométrie améliore le taux de dépistage des cardiopathies congénitales grave. Elle est recommandée pour tous les nouveau-nés du Canada, particulièrement en conjugaison avec l’échographie prénatale et l’examen physique.
- Puisque les pratiques d’accouchement et le moment du congé varient selon les régions du Canada, il faut personnaliser le moment du dépistage dans chaque centre, mais idéalement, le prévoir plus de 24 heures après la naissance pour réduire le taux de résultats faussement positifs. Comme l’objectif consiste à procéder au dépistage des nouveau-nés avant l’apparition des symptômes, ce dépistage doit toutefois avoir lieu avant l’âge de 36 heures.
- Le test à la main droite et à l’un des pieds réduit le taux de résultats faussement négatifs.
- Dans un système de soins rigoureux, il faut s’assurer que les nouveau-nés soient soumis au dépistage et profitent d’un suivi, s’ils en ont besoin.
- Lorsqu’un nouveau-né ÉCHOUE au dépistage, le dispensateur de soins qui a la plus grande responsabilité de l’enfant doit procéder à une évaluation clinique complète, ce qui peut inclure une consultation avec un pédiatre lorsque celle-ci n’avait pas eu lieu lors de l’évaluation initiale. S’il est impossible d’exclure un diagnostic de trouble cardiaque, il est recommandé d’orienter le nouveau-né vers un cardiologue pédiatre et de lui faire subir une échocardiographie.
Remerciements
Le comité de la pédiatrie communautaire de la Société canadienne de pédiatrie a révisé le présent point de pratique, de même que des représentants du Collège des médecins de famille du Canada et de la Société des obstétriciens et gynécologues du Canada.
COMITÉ D’ÉTUDE DU FŒTUS ET DU NOUVEAU-NÉ DE LA SCP
Membres : Mireille Guillot MD (membre résidente), Leonora Hendson MD, Ann Jefferies MD (présidente sortante), Thierry Lacaze-Masmonteil MD (président), Brigitte Lemyre MD, Michael Narvey MD, Leigh Anne Newhook MD (représentante du conseil), Vibhuti Shah MD
Représentants : Linda Boisvert inf., Association canadienne des infirmières et infirmiers en néonatologie; Radha Chari MD, La Société des obstétriciens et gynécologues du Canada; James Cummings MD, comité d’étude du fœtus et du nouveau-né, American Academy of Pediatrics; Doris Sawatsky-Dickson, inf. M. Sc. inf. IBCLC, Association canadienne des infirmières et infirmiers en néonatologie; William Ehman MD, Le Collège des médecins de famille du Canada; Roxanne Laforge inf., Partenariat des programmes périnatals du Canada; Chantal Nelson Ph. D., Agence de la santé publique du Canada; Eugene H Ng MD, section de la médecine néonatale et périnatale de la SCP; Kristi Watterberg MD, comité d’étude du fœtus et du nouveau-né, American Academy of Pediatrics
Auteurs principaux : Michael Narvey MD, Kenny K Wong MD, Anne Fournier MD
Références
- Meberg A, Andreassen A, Brunvand L et coll. Pulse oximetry screening as a complementary strategy to detect critical congenital heart defects. Acta Paediatr 2009;98(4):682–6.
- Zhao QM, Ma XJ, Ge XL et coll.; Neonatal Congenital Heart Disease screening group. Pulse oximetry with clinical assessment to screen for congenital heart disease in neonates in China: A prospective study. Lancet 2014;384(9945):747–54.
- Mahle WT, Newburger JW, Matherne GP et coll.; American Heart Association Congenital Heart Defects Committee of the Council on Cardiovascular Disease in the Young, Council on Cardiovascular Nursing, and Interdisciplinary Council on Quality of Care and Outcomes Research; American Academy of Pediatrics Section on Cardiology and Cardiac Surgery; Committee on Fetus and Newborn. Role of pulse oximetry in examining newborns for congenital heart disease: A scientific statement from the AHA and AAP. Pediatrics 2009;124(2):823–36.
- Thangaratinam S, Brown K, Zamora J, Khan KS, Ewer AK. Pulse oximetry screening for critical congenital heart defects in asymptomatic newborn babies: A systematic review and meta-analysis. Lancet 2012;379(9835):2459–64.
- Wong KK, Fournier A, Fruitman DS et coll. Canadian Cardiovascular Society/Canadian Pediatric Cardiology Association position statement on pulse oximetry screening in newborns to enhance detection of critical congenital heart disease. Can J Cardiol 2017;33(2):199–208.
- Marelli AJ, Mackie AS, Ionescu-Ittu R , Rahme E, Pilote L. Congenital heart disease in the general population: Changing prevalence and age distribution. Circulation 2007;115(2):163–72.
- Brown KL, Ridout DA, Hoskote A, Verhulst L, Ricci M, Bull C. Delayed diagnosis of congenital heart disease worsens preoperative condition and outcome of surgery in neonates. Heart 2006;92(9):1298–302.
- Peterson C, Ailes E, Riehle-Colarusso T et coll. Late detection of critical congenital heart disease among US infants: Estimation of the potential impact of proposed universal screening using pulse oximetry. JAMA Pediatr 2014;168(4):361–70.
- Wren C, Reinhardt Z, Khawaja K. Twenty-year trends in diagnosis of life-threatening neonatal cardiovascular malformations. Arch Dis Child Fetal Neonatal Ed 2008;93(1):F33–5.
- de-Wahl Granelli A, Wennergren M, Sandberg K et coll. Impact of pulse oximetry screening on the detection of duct dependent congenital heart disease: A Swedish prospective screening study in 39,821 newborns. BMJ 2009;338:a3037.
- Dow KE, Wong KK. Test de saturométrie néonatale : Résultats 2016. Programme canadien de surveillance pédiatrique. Février 2016. www.pcsp.cps.ca/uploads/publications/Resultats-du-PCSP-2016.pdf (consulté en février 2016).
- Trines J, Fruitman D, Zuo KJ, Smallhorn JF, Hornberger LK, Mackie AS. Effectiveness of prenatal screening for congenital heart disease: Assessment in a jurisdiction with universal access to health care. Can J Cardiol 2013;29(7):879–85.
- Quartermain MD, Pasquali SK, Hill KD et coll. Variation in prenatal diagnosis of congenital heart disease in infants. Pediatrics 2015;136(2):e378–85.
- Riede FT, Wörner C, Dähnert I, Möckel A, Kostelka M, Schneider P. Effectiveness of neonatal pulse oximetry screening for detection of critical congenital heart disease in daily clinical routine–results from a prospective multicenter study. Eur J Pediatr 2010;169(8):975–81.
- Ewer AK, Middleton LJ, Furmston AT et coll.; PulseOx Study Group. Pulse oximetry screening for congenital heart defects in newborn infants (PulseOx): A test accuracy study. Lancet 2011;378(9793):785–94.
- Kochilas LK, Lohr JL, Bruhn E et coll. Implementation of critical congenital heart disease screening in Minnesota. Pediatrics 2013;132(3):e587–94.
- Roberts TE, Barton PM, Auguste PE, Middleton LJ, Furmston AT, Ewer AK. Pulse oximetry as a screening test for congenital heart defects in newborn infants: A cost-effectiveness analysis. Arch Dis Child 2012;97(3):221–6.
- Peterson C, Grosse SD, Glidewell J et coll. A public health economic assessment of hospitals’ cost to screen newborns for critical congenital heart disease. Public Health Rep 2014;129(1):86–93.
- Meberg A, Brügmann-Pieper S, Due R Jr et coll. First day of life pulse oximetry screening to detect congenital heart defects. J Pediatr 2008;152(6):761–5.
- Nelson HD, Bougatsos C, Nygren P; 2001 US Preventive Services Task Force. Universal newborn hearing screening: Systematic review to update the 2001 US Preventive Services Task Force Recommendation. Pediatrics 2008;122(1):e266–76.
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.
Mise à jour : le 8 février 2024

