Point de pratique

L’allergie aux bêta-lactamines dans la population pédiatrique
Affichage : le 30 janvier 2020
Auteur(s) principal(aux)
Tiffany Wong, Adelle Atkinson, Geert t’Jong, Michael J. Rieder, Edmond S. Chan, Elissa M.Abrams; Société canadienne de pédiatrie, Section des allergies
Paediatr Child Health 2020 25(1):63. (Résumé) 
Résumé
L’allergie aux bêta-lactamines est souvent diagnostiquée chez les patients pédiatriques, mais plus de 90 % de ceux qui déclarent en être victimes peuvent tolérer les médicaments prescrits après avoir été évalués par un allergologue. Une « étiquette » d’allergie aux bêta-lactamines est liée à des résultats cliniques et administratifs négatifs, y compris l’utilisation d’autres antibiotiques moins indiqués, des hospitalisations plus longues, une augmentation des infections antibiorésistantes et des coûts médicaux plus élevés. De plus, pour les enfants ayant une véritable allergie à médiation IgE aux pénicillines, on conseille souvent d’éviter toutes les bêta-lactamines, y compris les céphalosporines, ce qui n’est probablement pas nécessaire chez plus de 97 % de ceux qui déclarent être allergiques à la pénicilline. La plupart des patients peuvent recevoir un traitement à la pénicilline ou à l’amoxicilline s’ils n’ont pas d’antécédents compatibles avec des réactions à médiation IgE ni avec des réactions systémiques tardives comme le syndrome de Stevens-Johnson, une réaction de type maladie sérique, le syndrome d’éruption médicamenteuse avec éosinophilie et manifestations systémiques ou la pustulose exanthématique aiguë généralisée. Des directives sont proposées pour stratifier le risque d’allergie aux bêta-lactamines ainsi que pour administrer des doses tests aux patients considérés comme à faible risque et les surveiller en milieu ambulatoire. Les directives sur les patients à plus haut risque d’allergie aux bêta-lactamines comprennent les critères pour les diriger vers des allergologues et l’utilisation d’autres antimicrobiens tels que les céphalosporines, en attendant l’évaluation par un spécialiste.
Mots-clés : Beta-lactam; Challenge; Drug allergy; Penicillin
Historique
La définition et la catégorisation des allergies aux bêta-lactamines
L’Organisation mondiale de la Santé définit les allergies aux médicaments comme des réactions d’hypersensibilité à médiation immunologique [1]. Depuis longtemps, la classification de l’hypersensibilité de Gell et Coombs est utilisée pour catégoriser les allergies aux médicaments (tableau 1). Sur le plan clinique, les allergies aux médicaments sont généralement classées comme suit : hypersensibilité immédiate (qui se manifeste généralement dans l’heure) ou retardée (qui se manifeste au bout de plus d’une heure, mais souvent de plusieurs jours ou de plusieurs semaines) après le début de l’administration du médicament. Seules les allergies aux médicaments à médiation IgE font partie de la catégorie immédiate.
|
Réaction immunitaire
|
Délai d’apparition postexposition
|
Présentation clinique
|
|
Type I (à médiation IgE)
|
≤1 à 2 heures
|
Urticaire ou angiœdème, détresse respiratoire, symptômes gastro-intestinaux, hypotension, anaphylaxie
|
|
Type II (cytotoxique)
|
10 heures à plusieurs semaines
|
Anémie, thrombopénie
|
|
Type III (complexe immun)
|
1 à 3 semaines
|
Réaction de type maladie sérique : fièvre, urticaire, vasculite, arthrite ou arthralgie
|
|
Type IV (à médiation par les lymphocytes T)
|
2 à 14 jours
|
Éruption maculopapulaire, syndrome de Stevens-Johnson, syndrome d’éruption médicamenteuse avec éosinophilie et manifestations systémiques, pustulose exanthématique aiguë généralisée
|
|
Adapté et traduit de la référence 8
|
||
Bien qu’elles soient rares, les réactions de type 1 inquiètent bien des patients et des praticiens. Il est peu probable qu’elles se manifestent lors du premier cycle de traitement puisqu’il faut être exposé pour être sensibilisé [2]. Les réactions anaphylactiques aux pénicillines sont rares, car elles sont signalées chez moins de 1 % des enfants et des jeunes adultes. Les thérapies parentérales prolongées (notamment à fortes doses) entraînent un risque d’allergie aux bêta-lactamines plus élevé que les thérapies intermittentes par voie orale. Par ailleurs, il n’est pas démontré que des antécédents familiaux d’allergie aux bêta-lactamines accroissent le risque individuel [2].
Même si les exanthèmes maculopapulaires liés aux bêta-lactamines sont considérés comme de véritables allergies de type IV chez environ 5 % des adultes, celles-ci sont beaucoup moins courantes chez les enfants, puisqu’on estime qu’elles touchent moins de 2 % de cette population. La plupart des exanthèmes maculopapulaires chez les enfants sont d’origine infectieuse et n’empêchent pas l’utilisation des antibiotiques [2][3].
L’épidémiologie
On attribue une allergie aux bêta-lactamines à 5 % à 8 % des enfants d’Amérique du Nord et d’Europe [4]. De plus, de 94 % à 96 % des patients pédiatriques à qui on attribue une allergie aux bêta-lactamines et qui sont dirigés vers un allergologue tolèrent les tests de provocation aux bêta-lactamines, lors de l’évaluation plus approfondie [3][5].
Les patients pédiatriques à qui on attribue une allergie aux bêta-lactamines reçoivent souvent un faux diagnostic à cause d’une mauvaise classification des symptômes ou d’effets secondaires courants aux antibiotiques. Une interaction entre l’antibiotique et un agent pathogène imite parfois une réaction allergique [6]. Les anticorps IgE spécifiques aux bêta-lactamines en circulation peuvent diminuer naturellement au fil du temps [7]. Cependant, de nombreux patients ne sont jamais réévalués et conservent leur étiquette d’allergie.
La structure et les propriétés des bêta-lactamines
Les bêta-lactamines (pénicillines et céphalosporines) partagent un anneau bêta-lactame. Les médicaments diffèrent selon les divers groupes R de la chaîne latérale acyle (figure 1). Les bêta-lactamines développent un potentiel allergène lorsque l’anneau bêta-lactame s’ouvre et se lie aux protéines sanguines avoisinantes.
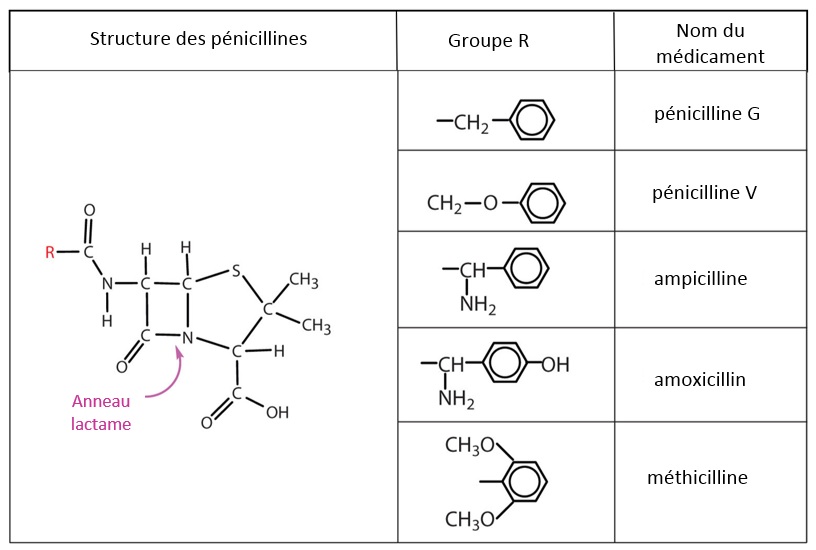 |
|
Source : Seetaram Swamy S. Penicillins, diapositive 13 : www.slideshare.net/seetaram443/penicillins-53561419
|
La réactivité croisée entre les bêta-lactamines chez les personnes allergiques
La réactivité croisée entre les pénicillines est principalement causée par des similarités dans la structure principale en anneau et dans les chaînes latérales. Elle ne peut pas être déterminée par les seules similarités entre les chaînes latérales. Lorsqu’un enfant présente une véritable allergie à une pénicilline, il faut éviter toutes les pénicillines.
On a déjà cru que de 10 % à 20 % des personnes allergiques aux pénicillines étaient également allergiques aux céphalosporines et qu’elles devaient éviter toutes les céphalosporines. Cependant, on sait maintenant que cette incidence était surestimée et que les précautions connexes étaient trop restrictives. Même si ces médicaments partagent un anneau bêta-lactame (figure 2), les données probantes ont démontré que cette structure est rarement responsable de l’allergie [2]. Tous les cas précoces déclarés touchaient des patients qui avaient pris des médicaments de première génération. Il a été établi que les céphalosporines produites avant les années 1980 étaient contaminées par la pénicilline et que ces réactions précoces étaient essentiellement causées par des chaînes latérales aux structures similaires (tableaux 2 et 3). Par exemple, un enfant ayant une allergie confirmée à l’amoxicilline est susceptible de réagir à la céphalexine en raison de la chaîne latérale du groupe 2 située à la position C-7. On pense ainsi que le véritable taux de réactivité croisée s’élève à environ 2 % [2]. Puisque la véritable incidence d’allergie à la pénicilline chez les patients qui affirment présenter des antécédents ne dépasse pas 10 %, on estime désormais que le taux de réactivité croisée est inférieur à 1 % chez les patients ayant une allergie autodéclarée, mais non confirmée.
|
Réactivité croisée au sein des groupes, liée à des chaînes latérales semblables
|
||
|
Groupe 1
|
Groupe 2
|
Groupe 3
|
|
céfoxitine
céfalotine
céphaloridine
pénicilline G
|
céfaclor
céphradine
céfalexine
céfadroxil
céfatrizine
cefprozil
amoxicilline
ampicilline
|
céfépime
ceftizoxime
cefpirome
céfotaxime
cefpodoxime
ceftriaxone
céfétamet
ceftérame
|
|
Adapté et traduit de la référence 8
|
||
|
Réactivité croisée au sein des groupes, liée à des chaînes latérales semblables
|
|||||
|
Groupe 1
|
Groupe 2
|
Groupe 3
|
Groupe 4
|
Groupe 5
|
Groupe 6
|
|
céfadroxil
céphalexine
céphradine
|
cefmétazole
céfopérazone
céfotétan
céfamandole
|
céfotaxime
céfalotine
céphapirine
|
ceftibuten
ceftizoxime
|
céfuroxime
céfoxitine
|
cefdinir
céfixime
|
|
Adapté et traduit de la référence 8
|
|||||
Un aperçu de l’évaluation de l’allergie aux bêta-lactamines
Il est essentiel d’obtenir une anamnèse détaillée pour évaluer une éventuelle allergie aux bêta-lactamines et le niveau de risque pour le patient, puis pour décider si un test cutané ou un test de provocation orale est indiqué. Dans la mesure du possible, un médecin doit évaluer et examiner le patient pendant la réaction présumée. Les explorations dépendront de la nature de cette réaction.
|
Questions importantes à poser lors de l’anamnèse du patient après une réaction présumée
|
Les tests épicutanés et intradermiques
Les directives internationales sur l’évaluation des allergies à médiation IgE recommandent les tests épicutanés et intradermiques à l’aide de réactifs validés et standardisés de la pénicilline. Même si la valeur prédictive négative des tests cutanés pour l’allergie à la pénicilline chez les adultes avoisine les 100 %, une récente étude canadienne a révélé que cette valeur prédictive est faible chez les enfants, puisque les résultats des tests sont négatifs chez 94 % de ceux qui ont obtenu un test de provocation orale positif [5]. Ainsi, les tests cutanés sont moins susceptibles d’être utiles chez les enfants que chez les adultes. Ils ne sont d’ailleurs pas utiles pour dépister les allergies quand il n’y a pas d’histoire de réaction convaincante, car la valeur prédictive positive de l’allergie à la pénicilline peut être aussi basse que 40 % [2].
Les tests de provocation aux médicaments
Le test de référence pour exclure une allergie à médiation IgE est le test de provocation à un médicament effectué après qu’une anamnèse détaillée accompagnée ou non d’un test cutané ait indiqué que le patient est peu susceptible d’être allergique. Les tests cutanés à l’aide de réactifs standardisés sont spécifiques à la pénicilline et n’écartent pas nécessairement l’allergie à d’autres membres du groupe des pénicillines possédant d’autres chaînes latérales (p. ex., l’amoxicilline). Ainsi, il est préférable d’exécuter le test de provocation au médicament visé par voie orale. Il n’y a pas de consensus international quant au mode d’exécution des tests de provocation. De nombreux centres canadiens effectuent un test de provocation à une dose, mais d’autres optent pour une dose graduée en deux étapes (c’est-à-dire l’administration de 10 % de la dose, suivie des 90 % restants 30 minutes plus tard). Les tests de provocation aux médicaments effectués chez des patients bien sélectionnés sont sécuritaires et efficaces, et selon des données récentes, il est plus fiable de passer directement au test de provocation par voie orale, sans test cutané [5]. Les tests de provocation aux médicaments peuvent être dangereux et sont contre-indiqués lorsque l’anamnèse est indicatrice d’une anaphylaxie récente ou d’une réaction immunologique systémique non immédiate (p. ex., réaction de type maladie sérique, syndrome de Stevens-Johnson, syndrome d’éruption médicamenteuse avec éosinophilie et manifestations systémiques ou anémie hémolytique induite par un médicament).
Les conséquences cliniques d’un faux diagnostic d’allergie aux bêta-lactamines
Il faut être d’une extrême prudence pour poser un diagnostic d’allergie aux médicaments chez les enfants, parce qu’une étiquette inexacte d’allergie à la pénicilline est liée à des résultats cliniques et administratifs négatifs. Les antimicrobiens non bêta-lactamines de deuxième ligne fonctionnent généralement moins bien pour traiter les infections et sont liés à des hospitalisations prolongées, à des taux d’admission plus élevés en soins intensifs, à des réhospitalisations et à la mortalité. Étant donné l’utilisation accrue d’antibiotiques à large spectre de rechange, l’antibiorésistance augmente et inclut désormais l’entérocoque résistant à la vancomycine et le S. aureus résistant à la méthicilline (SARM), de même qu’un taux plus élevé d’infections à C. difficile. La hausse des frais de santé dans le monde est attribuable en partie au coût plus élevé des antibiotiques à chaque hospitalisation et aux hospitalisations prolongées. Il est démontré que le retrait de l’étiquette erronée d’allergie à la pénicilline atténue ces deux tendances [10]. Les programmes de désétiquetage de l’allergie à la pénicilline deviennent une stratégie clé des programmes de gestion des antimicrobiens en Amérique du Nord.
Des allergologues pédiatriques, un pharmacien responsable de la gestion des antimicrobiens, un pédiatre général et des infectiologues pédiatriques ont évalué la figure 3. Un peu plus de 60 % des sujets qu’un allergologue considérait comme non allergiques le jour même de leur rendez-vous clinique auraient pu être considérés comme à faible risque d’après leur seule anamnèse, obtenue au moyen du questionnaire et conformément à l’algorithme. Aucun patient considéré comme à faible risque n’a ensuite été diagnostiqué comme allergique par un allergologue, ce qui démontre la sécurité et la fiabilité de cet outil clinique.
La Figure 3 : Algorithme pour déterminer les patients pédiatriques à faible risque d’allergie à la pénicilline peut être consultée sous forme de fichier supplémentaire.
Les principes généraux de l’allergie aux bêta-lactamines dans la population pédiatrique
Les enfants qui ont une histoire de réaction présumée à la pénicilline, mais qui ont toléré un cycle de médicament par la suite ne sont pas allergiques. Ces antibiotiques peuvent être prescrits de nouveau sans surveiller l’administration de la dose.
Les enfants à faible risque d’allergie à la pénicilline peuvent se faire prescrire de nouveau les médicaments en toute sécurité. Les exanthèmes légers et tardifs ne contre-indiquent pas davantage l’utilisation de ces antibiotiques. L’administration d’une seule dose test d’amoxicilline (15 mg/kg) suivie d’une période d’observation d’une heure peut être rassurante et confirmer l’absence d’allergie. Ces enfants peuvent se faire prescrire des céphalosporines (aux chaînes latérales semblables ou non), des carbapénèmes et des monobactames sans qu’il soit nécessaire de surveiller l’administration de la dose.
Les enfants chez qui on soupçonne une allergie à médiation IgE ne doivent pas se faire prescrire de la pénicilline. Ils doivent être dirigés vers un allergologue pédiatrique en vue d’être évalués. Lorsqu’on présume une allergie à médiation IgE, il faut éviter de prescrire des céphalosporines aux chaînes latérales semblables. Il est toutefois possible de prescrire des céphalosporines ayant des chaînes latérales différentes. Lorsque c’est nécessaire (p. ex., pour les patients qui ont besoin de prendre fréquemment des antibiotiques à cause d’une maladie chronique) ou que certaines céphalosporines sont souhaitables, il est possible d’exécuter un test de provocation à la céphalosporine qu’une équipe soignante aimerait sélectionner.
Les enfants qui, après une dose de pénicilline, ont présenté de graves réactions indésirables tardives, systémiques ou cutanées, ne devraient pas se faire prescrire cet antibiotique par la suite. Ils doivent être dirigés vers un allergologue pédiatrique en vue de se faire évaluer et conseiller. Aucunes données probantes robustes n’indiquent une réactivité croisée entre des pénicillines précises ou des pénicillines et des céphalosporines aux chaînes latérales semblables lors de graves réactions allergiques tardives. De futures décisions quant à l’utilisation d’autres pénicillines que celles responsables des réactions doivent dépendre de leurs avantages par rapport à l’évaluation des risques, et ce, en fonction de chaque cas. Certaines organisations recommandent alors d’éviter les céphalosporines aux chaînes latérales semblables [11].
Les enfants qui ont reçu un diagnostic d’allergie à la pénicilline par un allergologue doivent se faire réévaluer par un allergologue pédiatrique au bout de cinq ans. Ils pourraient s’être débarrassés de cette allergie. Par conséquent, il n’est pas toujours nécessaire qu’ils évitent la pénicilline jusqu’à la fin de leurs jours.
Remerciements
Le comité de la pédiatrie communautaire et le comité des maladies infectieuses et d’immunisation de la Société canadienne de pédiatrie ont révisé le présent point de pratique. Les docteurs Geert t’Jong and Michael J. Rieder, deux membres du comité de la pharmacologie et des substances dangereuses de la Société canadienne de pédiatrie, en sont les coauteurs.
COMITÉ DIRECTEUR DE LA SECTION DES ALLERGIES DE LA SOCIÉTÉ CANADIENNE DE PÉDIATRIE
Membres du comité directeur : Elissa M. Abrams MD (présidente), Edmond S. Chan MD (secrétaire-trésorier)
Auteurs principaux : Tiffany Wong MD, Adelle Atkinson MD, Geert t’Jong MD, Michael J. Rieder MD, Edmond S. Chan MD, Elissa M. Abrams MD
Références
- Johansson SG, Bieber T, Dahl R et coll. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol 2004;113(5):832–36.
- Joint Task Force on Practice Parameters; American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. Drug allergy: An updated practice parameter. Ann Allergy Asthma Immunol 2010;105(4):259-73.
- Abrams EM, Wakeman A, Gerstner TV, Warrington RJ, Singer AG. Prevalence of beta-lactam allergy: A retrospective chart review of drug allergy assessment in a predominantly pediatric population. Allergy Asthma Clin Immunol 2016;12:59.
- Gomes ER, Brokow K, Kuyucu S et coll. Drug hypersensitivity in children: Report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy 2016;71(2):149-61.
- Mill C, Primeau MN, Medoff E et coll. Assessing the diagnostic properties of a graded oral provocation challenge for the diagnosis of immediate and nonimmediate reactions to amoxicillin in children. JAMA Pediatr 2016;170(6):e160033.
- Pichler WJ. Delayed drug hypersensitivity reactions. Ann Intern Med 2003:139(8):683-93.
- Blanca M, Torres MJ, Garcia JJ et coll. Natural evolution of skin test sensitivity in patients allergic to beta-lactam antibiotics. J Allergy Clin Immunol 1999;103(5 Pt 1):918-24.
- Pichichero ME. A review of evidence supporting the American Academy of Pediatrics recommendation for prescribing cephalosporin antibiotics for penicillin-allergic patients. Pediatrics 2005;115(4):1048-57.
- Macy E, Contreras R. Health care use and serious infection prevalence associated with beta-lactam “allergy” in hospitalized patients: A cohort study. J Allergy Clin Immunol 2014;133:790e796
- Trubiano JA, Thursky KA, Stewardson AJ et coll. Impact of an integrated antibiotic allergy testing program on antimicrobial stewardship: a multi-center evaluation. Clin Infect Dis 2017;65(1):166-74.
- Gouvernement du Québec, Institut national d’excellence en santé et en services sociaux. Avis sur la standardisation des pratiques relatives aux allergies aux bêta-lactamines. Juin 2017. www.inesss.qc.ca/nc/en/publications/publications/publication/avis-sur-la-standardisation-des-pratiques-relatives-aux-allergies-aux-beta-lactamines-modification.html (consulté le 15 août 2019).
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.
Mise à jour : le 8 février 2024

