Document de principes

La prévention et la prise en charge des infections par le virus herpès simplex
Affichage : le 6 mars 2020
Auteur(s) principal(aux)
Upton D Allen, Joan L Robinson; Société canadienne de pédiatrie, Comité des maladies infectieuses et d’immunisation
Résumé
Chez les nouveau-nés, l’infection par le virus herpès simplex humain (VHS) peut avoir des conséquences cliniques dévastatrices, y compris la mortalité et une importante morbidité. Tous les nourrissons sont vulnérables à l’infection par le VHS néonatal. Le présent document de principes contient une analyse de l’épidémiologie, de la transmission et des facteurs de risque et s’attarde tout particulièrement sur l’infection intrapartum. Il présente une évaluation du diagnostic et du pronostic selon la catégorie d’infection, de même que les modalités et les limites des examens. Les recommandations relatives à la prise en charge des nouveau-nés dont l’exposition au VHS intrapartum est confirmée se fondent sur des avis d’experts, car il est impossible de procéder à un essai aléatoire pour comparer les possibilités thérapeutiques. Des conseils sont donnés pour la prise en charge empirique des nourrissons chez qui on craint un sepsis clinique, y compris ceux qui ne répondent pas à la thérapie antibactérienne. Le présent document de principes remplace celui que la Société canadienne de pédiatrie a publié en 2006.
Mots-clés : Acyclovir; CNS; Encephalitis; SEM; Sepsis
L’épidémiologie
Les taux estimatifs d’infection par le virus herpès simplex néonatal humain (VHSN) varient selon les régions du monde.[1][2] Au Canada, environ un nouveau-né sur 16 500 est infecté, ce qui correspond à environ six cas sur 100 000 naissances vivantes.[1] Le virus herpès simplex (VHS) génital de type 1 (VHS-1) ou de type 2 (VHS-2) peut être transmis au nouveau-né. Dans le monde, on estime que 75 % des cas de VHSN sont attribuables au VHS-2, et 25 %, au VHS-1.(3) Une étude prospective canadienne qui contenait une analyse des déclarations entre 2000 et 2003 a révélé que 63 % des cas étaient attribuables au VHS-1.[1] Des études menées en Ontario (en 2000 et 2001)[4] et en Colombie-Britannique (en 1999)[5] auprès de nourrissons potentiellement vulnérables au VHS-2 ont permis de déceler des anticorps contre le VHS-2 chez 10 % et 17 % des femmes enceintes, respectivement.
De nombreux facteurs influent sur la transmission de l’infection par le VHS aux nouveau-nés, y compris la nature de l’infection de la mère, le mode d’accouchement, la durée de la rupture des membranes et l’utilisation d’instruments intrapartum.
Les cas de VHS génital de la mère se classent comme suit :[6]
- Nouvelle infection
- Premier épisode de primo-infection (au début, la mère ne présente pas d’anticorps sériques contre le VHS-1 ou le VHS-2)
- Premier épisode d’infection non primaire (la mère a une nouvelle infection par un type de VHS en présence des anticorps de l’autre type)
- Infection récurrente (la mère possédait déjà des anticorps contre le type de VHS isolé dans les voies génitales)
Le mode d’acquisition du VHSN le plus courant et le plus important se fait par voie intrapartum. Même quand il s’agit du VHS-1, plus de 75 % des cas de VHSN sont acquis pendant l’accouchement, souvent à cause d’une nouvelle infection génitale asymptomatique.[7] Les nouveau-nés peuvent également contracter l’infection par le VHS transmis in utero ou après la naissance. Même si elle est rare, l’infection par le VHS in utero peut avoir des effets tératogènes, tels que des lésions ou des cicatrices cutanées, des troubles du système nerveux central (SNC) et une choriorétinite.[8] Le nourrisson peut contracter l’infection postnatale de sa mère ou d’une autre source (p. ex., membres de la parenté ou personnel de l’hôpital atteints d’herpès orolabial ou présentant une excrétion asymptomatique du VHS-1).[3][9]
Dans la plupart des cas d’infection par le VHSN, la mère n’a pas d’antécédents connus de VHS génital, parce qu’elle n’a jamais eu ou remarqué de lésions génitales externes auparavant. D’après les études, de 75 % à 90 % des personnes séropositives pour le VHS-2 ne se savaient pas infectées.[10] Ainsi, il faut considérer que tous les nourrissons peuvent être vulnérables à une infection par le VHSN. Les femmes séropositives excrètent le VIH dans leurs voies génitales de façon discontinue, mais la réaction en chaîne de la polymérase (PCR) révèle que de 10 % à 20 % des personnes atteintes du VHS-2 excrètent le virus chaque jour.[11]
La catégorie d’infection de la mère au moment de l’accouchement influe sur la probabilité d’acquisition du VHSN, sans doute parce que les mères infectées par le VHS transmettent des anticorps neutralisants contre le VHS à leur nourrisson à travers le placenta, s’il ne naît pas avant 32 semaines de grossesse.[7][12]-[14] Ainsi, les nourrissons nés d’une mère qui présente un premier épisode de primo-infection au moment de l’accouchement sont les plus vulnérables au VHS, les taux de transmission atteignant alors les 60 %, car celle-ci n’avait pas d’anticorps neutralisants à leur transmettre.[3] Chez les nourrissons nés d’une mère qui présente un premier épisode d’infection non primaire, les taux de transmission ne dépassent pas les 30 %, en raison de la réactivité croisée des anticorps. Les mères qui ont des infections récurrentes sont celles qui risquent le moins de transmettre l’infection à leur nouveau-né (moins de 2 %), car elles possèdent des anticorps spécifiques de type.[4]
L’accouchement par césarienne non urgente réduit considérablement le risque d’infection pour le nouveau-né, sans pour autant l’éliminer.[15][16] On prescrit souvent aux femmes atteintes d’une infection génitale récurrente un traitement prophylactique à l’acyclovir (ACV) ou au valacyclovir entre la 36e semaine de grossesse et l’accouchement. L’antivirothérapie près du terme peut alors réduire le risque de récurrence et d’excrétion du VHS génital à l’accouchement,[17] mais on ne sait pas si cette prophylaxie réduit le risque d’infection par le VHSN. Il existe des lignes directrices publiées sur le rôle de la césarienne et les indications pour prescrire de l’acyclovir,[16][18][19] mais elles ne sont pas détaillées dans le présent document.
Les interventions obstétricales, qui peuvent provoquer une abrasion du cuir chevelu ou une coupure de la peau du nourrisson pendant le travail et l’accouchement, peuvent accroître le risque de transmission du VHSN au nouveau-né. Dans la mesure du possible, il faut éviter les prélèvements et le monitorage fœtal sur le cuir chevelu ainsi que l’utilisation de forceps ou de ventouses[16][19]-[23] en présence de lésions génitales chez la mère.[16] Une rupture des membranes précoce ou prolongée peut également accroître le risque de transmission.
Les catégories et l’évolution de l’infection par le VHSN
Il peut être utile de classer les infections par le VHSN pour orienter le diagnostic et la prise en charge, et il est important de connaître cette classification pour établir un pronostic.[24] Les infections par le VHSN in utero sont rares, car elles représentent moins de 5 % des cas. La classification des infections acquises pendant la période périnatale, natale ou postnatale s’établit comme suit :
- VHS disséminé
- VHS localisé dans le SNC
- Infection limitée à la peau, aux yeux et aux muqueuses (de type PYM)
Les divers syndromes peuvent se chevaucher. La maladie disséminée touche plusieurs organes, notamment le foie et les poumons.
Dans la plupart des cas, les premiers symptômes d’infection par le VHSN se manifestent pendant les quatre premières semaines de vie. Il arrive toutefois qu’ils fassent leur apparition entre quatre et six semaines de vie.[4] C’est pourquoi jusqu’à 42 jours de vie, l’évaluation complète du VHSN s’impose lorsque les caractéristiques cliniques en évoquent la possibilité. Les nouveau-nés infectés in utero en présentent les caractéristiques à la naissance ou peu après.
L’absence de lésions cutanées ne permet pas d’écarter la possibilité d’un diagnostic de VHSN. En effet, dans une étude, 39 % des nourrissons atteints de l’infection disséminée n’avaient jamais présenté de lésions cutanées pendant leur maladie, de même que 32 % de ceux atteints d’une maladie du SNC et que 17 % de ceux atteints de l’infection de type PYM.[25] Il faut envisager un VHSN chez les nouveau-nés présentant un syndrome de sepsis, particulièrement lorsqu’il s’accompagne d’une dysfonction hépatique, même en l’absence d’antécédents de VHS par la mère et de vésicules cutanées chez le nourrisson. Une étude auprès de 32 nourrissons atteints d’un VHS périnatal a établi que 50 % des cas n’avaient que des symptômes non spécifiques et que 75 % faisaient seulement de la fièvre lorsqu’ils avaient été portés à l’attention du médecin. Ce sont surtout les nourrissons dont les symptômes se manifestaient avant l’âge de 21 jours qui présentaient des symptômes non spécifiques.[26] De plus, le VHS est à envisager chez les nouveau-nés qui font de la fièvre, sont irritables et dont les résultats des examens du liquide céphalorachidien (LCR) sont anormaux, surtout s’ils font des convulsions. Cependant, un examen initial normal du LCR n’exclut pas nécessairement un diagnostic d’infection du SNC par le VHSN.[26]
Les nourrissons atteints de l’infection disséminée sont moins susceptibles de survivre que ceux qui sont atteints de l’infection de type PYM ou du SNC. D’après les données, la dissémination est plus courante en cas de nouvelle infection de la mère par le VHS, probablement parce qu’elle n’a pas pu transférer d’anticorps neutralisants à son nourrisson in utero.[27],[28] Avant l’utilisation des antiviraux, on estime que 85 % des nourrissons atteints d’une infection par le VHS disséminée et que 50 % de ceux atteints d’une infection du SNC mouraient.[29] Grâce à l’ACV (60 mg/kg/jour), le taux de mortalité causée par l’infection disséminée et l’infection du SNC s’élevait à 29 % et à 14 %, respectivement, au bout d’un an.[30] Une étude canadienne sur des cas confirmés observés sur une période de trois ans (octobre 2000 à septembre 2003) faisait état d’un taux de mortalité de 15,5 %.[1]
Parmi les survivants qui ont participé à deux études sur l’administration d’ACV par voie parentérale et qui incluaient des données de suivi à l’âge de 12 mois, 25 % des patients atteints de l’infection disséminée affichaient des complications neurologiques, comparativement à 70 % de ceux atteints de l’infection limitée au SNC.[25] Des séquelles neurologiques à long terme étaient également constatées chez les nouveau-nés atteints d’une infection de type PYM (sans infection apparente du SNC).[28],[31] Des études plus récentes n’ont pourtant pas fait état de séquelles. Il semble donc probable que les nourrissons qui avaient des séquelles étaient atteints d’une infection non dépistée du SNC.[32]
Le diagnostic en laboratoire
Le clinicien doit parler à un spécialiste du laboratoire ou à un consultant en infectiologie s’il craint un VHSN, surtout dans les milieux où les tests du VHSN sont peu fréquents. Il est important de consulter des experts, car l’utilité des tests varie selon le type de prélèvement. Le laboratoire doit également fournir au centre de soins des conseils généraux et des conseils spécifiques quant au type d’échantillons à faire évaluer. Chaque test de laboratoire pour dépister le VHS comporte des limites importantes. Au moment d’interpréter les résultats, il faut donc bien tenir compte du contexte clinique ainsi que des examens non spécifiques, incluant l’électroencéphalographie, la tomodensitométrie ou l’imagerie par résonance magnétique, les taux de transaminases hépatiques et la numération plaquettaire.
Il est possible de déceler le VHS par culture virale, coloration par immunofluorescence directe ou dosage immunoenzymatique. Cependant, la PCR sur le LCR, les lésions cutanées, les muqueuses et le sang est considérée comme plus sensible et est désormais offerte dans la plupart des laboratoires. :
Lorsque les prélèvements sont réalisés dans les 24 heures suivant la naissance, le dépistage du virus dans des cultures superficielles peut être attribuable à une contamination cutanée pendant une exposition intrapartum.[4] Des prélèvements positifs réalisés après 24 heures de vie sont plus susceptibles de représenter une réplication virale active qu’une contamination. Il n’existe pas d’études prospectives sur l’utilité des cultures de surveillance périodiques pour le diagnostic précoce de l’infection par le VHSN chez les nourrissons qui ont été exposés à des lésions génitales actives.
Il faut faire preuve de prudence avant d’écarter la possibilité d’infection du SNC à VHS après avoir reçu une PCR négative du VHS sur le LCR, surtout lorsque le prélèvement a été réalisé aux premières phases de la maladie (avant l’âge de 24 à 48 heures). Si l’indice de suspicion est élevé, mais que la PCR sur le LCR est négative, deux possibilités sont à envisager : la reprise de la PCR sur le LCR dans les 72 heures suivant le début du traitement à l’acyclovir sera probablement positive chez les nourrissons atteints d’une infection à SNC sur le VHS, ou l’administration d’un traitement à l’acyclovir par voie intraveineuse pendant 21 jours pour traiter une infection éventuelle du SNC sur le VHS. Puisque l’infection du SNC peut être très discrète, tout patient chez qui on craint une infection par le VHSN devrait subir une ponction lombaire pour déceler le VHS dans le SCN par PCR sur le LCR dès que son état clinique le permet, à moins d’une contre-indication. Une infection du SNC par le VHSN est possible même si le LCR présente une numération cellulaire et des caractéristiques biochimiques « normales », notamment aux premières phases de l’infection. Par conséquent, il faut effectuer la PCR pour déceler le VHS dans le LCR même si ces paramètres sont normaux.
L’évaluation de la virémie attribuable au VHS, effectuée par une PCR, est moins bien établie que celle effectuée par une PCR sur le LCR.[33]-[35] Une étude dans laquelle les chercheurs évaluaient la charge virale du VHS dans le sérum et le LCR à l’aide de la PCR en temps réel a révélé que les patients atteints de l’infection disséminée présentaient une charge virale sérique plus élevée, tandis que ceux atteints d’une infection du SNC présentaient une charge virale du LCR plus élevée.[33] Les charges virales étaient également plus élevées chez les patients qui avaient succombé au VHS, ce qui laisse croire à l’utilité de cette mesure pour évaluer le pronostic des cas de VHSN. Un pronostic plus sombre est également lié à la persistance du VHS dans le LCR des patients traités à l’acyclovir.[33]
On possède peu d’expérience quant à la PCR des prélèvements pulmonaires, mais en cas de résultat positif à partir d’un prélèvement nasopharyngé chez un enfant atteint de pneumonie, il est fort probable que le nourrisson soit atteint d’une infection à VHSN disséminée.
La sérologie n’est pas utile pour diagnostiquer le VHSN, et ce, pour trois raisons principales. D’abord, il est impossible de différencier les anticorps de type immunoglobulines (Ig) G transplacentaires des IgG produites par le nourrisson. Ensuite, certains nourrissons très atteints ne peuvent produire d’anticorps. Enfin, la fiabilité des tests commerciaux pour déceler les anticorps IgM contre le VHS est à la fois variable et limitée.
La prise en charge des infections par le VHSN
L’acyclovir par voie intraveineuse est le traitement de première intention du VHSN. La dose recommandée est de 60 mg/kg/jour en trois doses fractionnées administrées toutes les huit heures, pourvu que la fonction rénale soit normale.[30] La durée du traitement dépend de la catégorie d’infection. En cas d’infection de type PYM, le traitement est de 14 jours, tandis que celui de l’infection disséminée ou de l’infection du SNC est d’au moins 21 jours. Puisque la biodisponibilité de l’ACV par voie orale est limitée, sa concentration thérapeutique est insuffisante.[36] C’est pourquoi la voie parentérale est recommandée. De plus fortes doses d’ACV s’associent à une neutropénie, et il faut veiller à une hydratation suffisante pour réduire le risque de néphrotoxicité.[30] En cas d’infection oculaire, il est recommandé d’utiliser un agent topique (p. ex., trifluridine 1 %) conjointement avec l’ACV par voie parentérale.[3]
Étant donné le risque de graves séquelles neurologiques chez les survivants d’une infection par le VHSN, les nourrissons atteints devraient être soumis à un programme de suivi structuré afin d’évaluer leur évolution neurodéveloppementale, ophtalmologique et auditive.
Il existe des recherches sur le rôle de la thérapie antivirale suppressive chez les nourrissons atteints d’une infection par le VHSN. Dans un récent essai à double insu, aléatoire et contrôlé contre placebo, les nourrissons atteints d’un VHS du SNC ou d’un VHS disséminé avec atteinte du SNC ont été évalués, tandis que dans un essai parallèle, ce sont les nourrissons atteints d’une infection à VHS de type PYM qui étaient évalués. Les nourrissons ayant une atteinte du SNC et qui avaient été sélectionnés au hasard pour prendre un traitement à l’ACV par voie orale pendant six mois obtenaient de meilleurs résultats sur le plan du développement que ceux qui avaient pris un placebo.[32] Chez les nourrissons ayant une infection de type PYM, le seul avantage du traitement était une diminution de l’incidence des récidives cutanées, qui peut permettre d’éviter la ponction lombaire et une réhospitalisation pour reprendre un traitement à l’ACV par voie intraveineuse en cas de réccurrence avant l’âge de six semaines.[37][38]
Recommandations
Les diagnostics d’infection par le VHSN en laboratoire
- Dès qu’un diagnostic de VHSN est envisagé, il est essentiel de demander des tests de laboratoire pour déceler le VHS, en plus d’examiner la peau et les muqueuses :
- Les examens standards du VHS incluent la PCR sur le LCR et les écouvillons des lésions vésiculaires et des muqueuses. On peut également vérifier la PCR sur le sang du VHS si on craint un VHSN disséminé. Après avoir discuté avec le laboratoire, il faut vérifier une échantillon nasopharyngé lorsque l’enfant est atteint d’une pneumonie. Les taux de transaminases hépatiques sériques sont mesurés pour étayer les preuves d’infection disséminée par le VHS.
- Pour évaluer l’infection par le VHSN chez les nourrissons exposés, mais asymptomatiques, il faut réaliser des écouvillons des muqueuses de la bouche, du nasopharynx et de la conjonctive au moins 24 heures après l’accouchement. D’autres écouvillons peuvent être réalisés (p. ex., aux foyers des électrodes sur le cuir chevelu, s’il y a lieu).
- L’ADN PCR pour le VHS dans le LCR est la méthode diagnostique de première intention pour diagnostiquer l’infection à VHC du SNC.
- Dans tous les examens précédents, les cliniciens et le personnel de laboratoire collaborent pour obtenir les résultats le plus rapidement possible.
La prise en charge des nourrissons à terme asymptomatiques dont la mère présente des lésions actives à l’accouchement (figures 1 et 2)
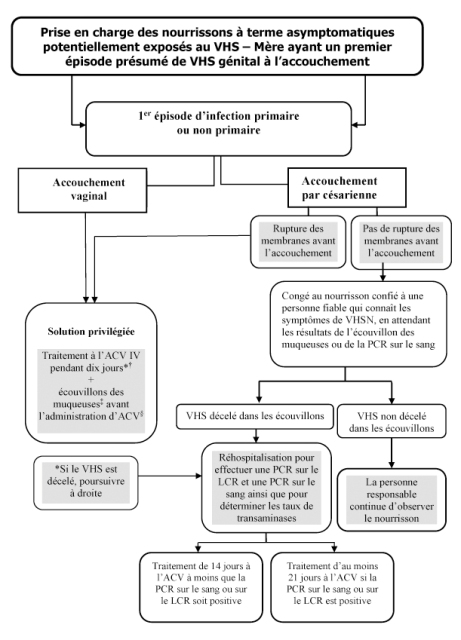 |
| Figure 1) ‡Le terme « écouvillon des muqueuses » désigne un écouvillon prélevé dans la conjonctive, la bouche et le nasopharynx; d’autres écouvillons peuvent être réalisés (p. ex., aux foyers des électrodes sur le cuir chevelu, s’il y a lieu). Outre les écouvillons des muqueuses, certains experts recommandent l’amplification en chaîne de la polymérase (PCR) sur le sang, si le test est offert. Les cliniciens devraient s’entretenir avec un spécialiste du laboratoire ou un consultant en infectiologie s’ils craignent un virus herpès simplex néonatal (VHSN) et demandent des examens de laboratoire. §Il convient de souligner que certains experts recommandent la numération cellulaire du liquide céphalorachidien (LCR), des examens biochimiques et une PCR lorsque des écouvillons des muqueuses sont réalisés (c’est-à-dire un bilan complet). IV voie intraveineuse |
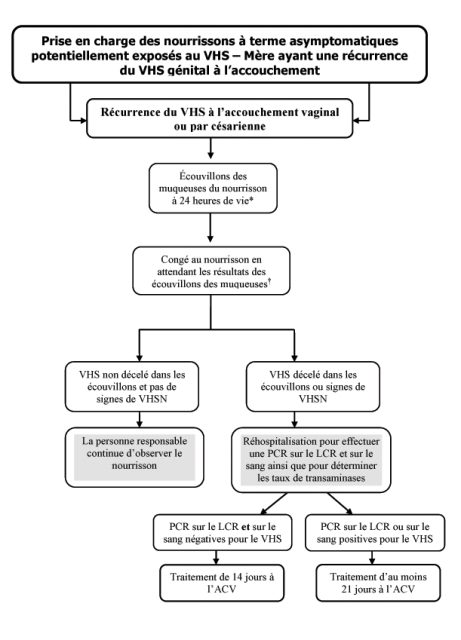 |
| Figure 2) *Certains experts considèrent les écouvillons comme optionnels en cas de césarienne sans rupture des membranes avant l’accouchement. Le terme « écouvillon des muqueuses » désigne un écouvillon prélevé dans la conjonctive, la bouche et le nasopharynx; d’autres écouvillons peuvent être réalisés (p. ex., aux foyers des électrodes sur le cuir chevelu, s’il y a lieu). †On présume que les parents maintiennent leur nourrisson sous observation à la maison, que des infirmières fassent ou non des visites à domicile. Les cliniciens devraient s’entretenir avec un spécialiste du laboratoire ou un consultant en infectiologie s’ils craignent un virus herpès simplex néonatal (VHSN) et demander des examens de laboratoire. ACV Acyclovir; LCR Liquide céphalorachidien; PCR amplification en chaîne de la polymérase |
- Lors d’un accouchement par césarienne avant la rupture des membranes
Le risque de VHSN est très faible. Si le nourrisson est bien, la mère et le nourrisson peuvent obtenir leur congé en attendant les résultats des écouvillons des membranes et du nasopharynx effectués à 24 heures de vie. Des personnes fiables qui s’occupent de l’enfant doivent être informées des signes d’infection par le VHSN. Certains experts recommandent également une PCR sur le sang, si elle est offerte. Si le VHS est décelé sur un écouvillon de la PCR sur le sang, le nourrisson doit être considéré comme un cas de VHSN et soigné en conséquence.
Remarque : Certains experts recommandent la numération cellulaire du LCR, des examens biochimiques et une PCR lorsque des écouvillons des muqueuses sont réalisés (c’est-à-dire un bilan complet).
- Premier épisode clinique d’infection par l’herpès génital lors d’un accouchement par voie vaginale ou par césarienne après la rupture des membranes
Il faut réaliser des écouvillons des muqueuses du nourrisson et commencer à lui administrer de l’ACV. La décision d’effectuer ce test à la naissance (malgré le risque de déceler une simple contamination de surface) ou à 24 heures de vie suscite la controverse. Certains experts recommandent également une PCR sur le sang, si elle est offerte. Chez le nourrisson, si les écouvillons ou la PCR sur le sang sont positifs, il faut obtenir une PCR sur le LCR pour déterminer la durée du traitement à l’ACV. Lorsque les écouvillons du nourrisson sont négatifs, le nourrisson devrait recevoir de l’ACV pendant dix jours.
Remarque : Certains experts recommandent la numération cellulaire du LCR, des examens biochimiques et une PCR lorsque des écouvillons des muqueuses sont réalisés (c’est-à-dire un bilan complet).
- Récurrence du VHS à l’accouchement – nourrisson né par césarienne
La même démarche qu’en cas de premier épisode d’infection avant la rupture des membranes est privilégiée.
- Récurrence du VHS à l’accouchement – nourrisson né par voie vaginale
Le clinicien réalise un écouvillon des muqueuses à 24 heures de vie et peut accorder son congé au nourrisson en attendant les résultats. Certains experts recommandent également une PCR sur le sang, si le test est offert. Le traitement à l’ACV n’est indiqué que si les écouvillons ou la PCR sur le sang sont positifs ou si le nourrisson présente des signes ou symptômes d’infection par le VHSN.
La prise en charge des nourrissons à terme asymptomatiques dont la mère n’avait pas de lésions actives à l’accouchement (y compris celles sous prophylaxie à l’ACV)
Il faut observer les signes de VHSN chez le nourrisson dont la mère a des antécédents de VHS, mais qui n’avait pas de lésions actives à l’accouchement; il n’est pas nécessaire de lui administrer d’ACV. L’écouvillonnage des muqueuses n’est pas recommandé systématiquement. Lorsque les premières manifestations cliniques du VHS se révèlent au troisième trimestre ou peu avant l’accouchement, les cliniciens peuvent envisager un écouvillonnage des muqueuses. Il faut alors informer les parents et les personnes qui s’occupent de l’enfant des signes et symptômes de VHSN.
La prise en charge du nouveau-né présentant des symptômes évocateurs d’un VHSN
Le VHS disséminé peut imiter le sepsis bactérien. Les cliniciens doivent donc envisager la possibilité d’infection par le VHSN chez les nourrissons malades de moins de six semaines de vie. En attendant la confirmation de laboratoire, ils peuvent envisager des examens et le traitement du VHSN auprès des patients vulnérables :
- Nourrissons chez qui on a amorcé une antibiothérapie IV en raison d’un sepsis présumé (notamment ceux qui ont des convulsions ou dont le LCR est anormal), dont l’état ne s’améliore pas rapidement et dont les cultures bactériennes sont négatives après 24 heures d’incubation
- Nourrissons hospitalisés en raison d’une pneumonie d’origine incertaine et dont l’état ne s’améliore pas après 24 heures sous antibiothérapie, surtout si le bilan radiologique évoque une pneumonie virale
- Nourrissons présentant des saignements inexpliqués aux foyers de la ponction veineuse ou une coagulopathie vérifiée, mais inexpliquée
- Nourrissons chez qui on a amorcé une antibiothérapie IV en raison d’un sepsis présumé et qui sont atteints d’une hépatite inexpliquée
Le traitement et le suivi des nourrissons infectés par le VHSN
- Le traitement précoce à l’ACV par voie intraveineuse (IV) améliore le pronostic dans les trois types de présentations du VHSN. Par conséquent, il faut amorcer l’ACV IV chez les nourrissons dès une présomption clinique d’infection, avant que le VHSN ait été confirmé en laboratoire,
- La dose recommandée est de 60 mg/kg/jour en trois doses fractionnées administrées toutes les huit heures, pourvu que la fonction rénale soit normale. Le traitement est de 14 jours si la maladie se limite à la peau, aux yeux ou à la bouche, et d’au moins 21 jours si l’infection touche le SNC ou est disséminée.
- Chez les enfants ayant une infection du SNC, il faudrait faire un prélèvement du LCR peu avant la fin du traitement de 21 jours. Si la PCR demeure positive, le traitement devrait se poursuivre et s’accompagner de prélèvements hebdomadaires du LCR, puis il faudrait mettre un terme à l’ACV à l’obtention d’un résultat négatif.
- Conjointement avec l’ACV parentéral, les nouveau-nés ayant une atteinte oculaire devraient d’abord recevoir un agent ophtalmique topique comme de la trifluridine. Il est essentiel d’obtenir une consultation en ophtalmologie, car en fonction de la gravité de la maladie, celle-ci pourra éclairer la décision d’utiliser un traitement d’association plutôt qu’une monothérapie.
- L’ACV par voie orale est contre-indiqué pour le traitement aigu du VHSN, parce que les concentrations sont trop faibles. Il suffit uniquement pour le traitement suppressif.
- Le traitement suppressif à l’ACV oral (300 mg/m2 par dose administrée trois fois par jour) devrait être prescrit pour une période de six mois aux nourrissons ayant une infection du SNC. Un outil de calcul de la surface corporelle, en anglais, figure à l’adresse www.csgnetwork.com/bsacalc.html. Les données sont moins convaincantes pour le traitement de l’infection de type PYM ou de l’infection disséminée, mais le traitement suppressif peut tout de même être proposé.
- Le suivi est indispensable pour déceler et prendre en charge les effets indésirables du traitement suppressif à l’ACV et les séquelles du VHSN. Il faut vérifier tous les mois la formule sanguine, ainsi que les taux d’urée et de créatinine afin de déceler tout effet indésirable et rajuster la dose d’ACV pour tenir compte de la croissance. Il faut suivre les nourrissons dans le cadre d’un programme qui permet d’évaluer les conséquences neurodéveloppementales, ophtalmologiques et auditives de l’infection par le VHSN.
La prévention des infections par le VHSN
Les stratégies pour prévenir le VHSN, y compris la détermination des grossesses à haut risque, l’accouchement par césarienne, l’antivirothérapie de la mère et les conseils préventifs aux futures mères et à leur conjoint, dépassent largement le cadre du présent document de principes. Cependant, les recommandations suivantes sont particulièrement pertinentes dans les pouponnières de soins spéciaux et les unités de soins intensifs néonatales.
Les mesures générales de contrôle des infections
Il existe des lignes directrices complètes sur le contrôle des infections,[39] mais trois groupes précis sont ciblés :
Nouveau-nés infectés par le VHS ou exposés à l’infection
- Les précautions de contact s’imposent auprès des nouveau-nés atteints d’une infection par le VHS qui ont des lésions mucocutanées, jusqu’à ce que celles-ci aient formé des croûtes.
- Les précautions de contact s’imposent auprès des nouveau-nés asymptomatiques dont la mère a des lésions actives du VHS, jusqu’à la fin de la période d’incubation (14e jour) ou à l’obtention des résultats négatifs sur les prélèvements réalisés après les 24 premières heures de vie. Certains experts ne recommandent pas les précautions de contact si le nourrisson exposé est né par césarienne et que les membranes se sont rompues moins de quatre à six heures avant l’accouchement.
Mères atteintes d’un VHS actif
- Les mères hospitalisées devraient se soumettre aux précautions de contact jusqu’à ce que leurs lésions aient formé des croûtes.
- Les mères atteintes d’herpès labial devraient porter un masque jetable lorsqu’elles s’occupent de leur nourrisson de moins de six semaines, jusqu’à ce que les lésions aient formé des croûtes sèches. Il faut leur conseiller de ne pas embrasser leur bébé. Il n’y a aucune contre-indication à l’allaitement, à moins de lésions herpétiques sur les seins.
- Les mères ayant des lésions cutanées devraient les couvrir en présence de leur nouveau-né.
Personnel ayant des lésions orofaciales ou cutanées
- Le personnel ayant des lésions cutanées causées par le VHS doit se plier à une hygiène méticuleuse des mains. Les membres du personnel en contact avec des nourrissons devraient couvrir leurs lésions. Si c’est impossible, ils doivent éviter les contacts avec les nouveau-nés.
- Certains experts recommandent le port du masque chirurgical pour couvrir les lésions orolabiales, qui ne peuvent être recouvertes d’un pansement.
- Les membres du personnel ayant une infection herpétique active à la main devraient éviter d’être en contact avec des nouveau-nés.
Remerciements
Le comité d’étude du fœtus et du nouveau-né et le comité de la pédiatrie communautaire de la Société canadienne de pédiatrie ont révisé le présent document de principes.
COMITÉ DES MALADIES INFECTIEUSES ET D’IMMUNISATION DE LA SCP
Membres : Robert Bortolussi (président sortant); Natalie A Bridger MD; Jane C Finlay MD (membre sortante); Susanna Martin MD (représentante du conseil); Jane C McDonald MD; Heather Onyett MD; Joan L Robinson MD (présidente); Marina I Salvadori MD (membre sortante); Otto G Vanderkooi MD
Conseillère : Noni E MacDonald MD
Représentants : Upton D Allen MBBS, Groupe de recherche canadien sur le sida chez les enfants; Michael Brady MD, comité des maladies infectieuses, American Academy of Pediatrics; Janet Dollin MD, Le Collège des médecins de famille du Canada; Charles PS Hui MD, Comité consultatif de la médecine tropicale et de la médecine des voyages, Agence de la santé publique du Canada; Nicole Le Saux MD, Programme canadien de surveillance active de la vaccination (IMPACT); Dorothy L Moore MD, Comité consultatif national de l’immunisation; John S Spika MD, Agence de la santé publique du Canada
Auteurs principaux : Upton D Allen MBBS; Joan L Robinson MD
Références
- Kropp RY, Wong T, Cormier L et coll. Neonatal herpes simplex virus infections in Canada: Results of a 3-year national prospective study. Pediatrics 2006(6);117:1955-62.
- Brown ZA, Wald A, Morrow RA, Selke S, Zeh J, Corey L. Effect of serologic status and Cesarean delivery on transmission rates of herpes simplex virus from mother to infant. JAMA 2003;289(2):203-9.
- American Academy of Pediatrics. Herpes simplex virus. In: Pickering LK, Baker CJ, Kimberlin DW, Long SS, éd. Red Book: 2012 Report of the Committee on Infections Diseases, 28e éd. Elk Grove Village: AAP, 2012:363-73.
- Howard M, Sellors JW, Jang D et coll. Regional distribution of antibodies to herpes simplex virus type 1 (HSV-1) and HSV-2 in men and women in Ontario, Canada. J Clin Microbiol 2003;41(1):84-9.
- Patrick DM, Dawar M, Cook DA, Krajden M, Ng HC, Rekart ML. Antenatal seroprevalence of herpes simplex virus type 2 (HSV-2) in Canadian women: HSV-2 prevalence increases throughout the reproductive years. Sex Transm Dis 2001;28(7):424-8.
- Arvin AM, Whitley RJ. Herpes simplex virus infections. In: Remington JS, Klein JO, éd. Infectious Diseases of the Fetus and Newborn. 7e éd. Philadelphie: WB Saunders, 2006.
- Corey L, Wald A. Maternal and neonatal herpes simplex virus infections. N Engl J Med 2009;361(14):1376-85.
- Marquez L, Levy ML, Munoz FM, Palazzi DL. A report of three cases and review of intrauterine herpes simplex virus infection. Pediatr Infect Dis J 2011;30(2):153-7.
- Kimberlin DW. Neonatal herpes simplex infection. Clin Microbiol Rev 2004;17(1):1-13.
- Gardella C, Brown Z. Prevention of neonatal herpes. BJOG 2011;118(2):187-92.
- Tronstein E, Johnston C, Huang ML et coll. Genital shedding of herpes simplex virus among symptomatic and asymptomatic persons with HSV-2 infection. JAMA 2011;305(14):1441-9.
- Yeager AS, Arvin AM, Urbani LJ, Kemp JA. Relationship of antibody to outcome in neonatal herpes simplex virus infections. Infect Immun 1980;29(2):532-8.
- Brown ZA, Selke S, Zeh J et coll. The acquisition of herpes simplex virus during pregnancy. N Engl J Med 1997;337(8):509-15.
- Sullender WM, Miller JL, Yasukowa LL et coll. Humoral and cell-mediated immunity in neonates with herpes simplex virus infection. J Infect Dis 1987;155(1):28-37.
- Tita AT. When is primary cesarean appropriate: Maternal and obstetrical indications. Semin Perinatol 2012;36(5):324-7.
- ACOG Committee on Practice Bulletins. Clinical management guidelines for obstetrician-gynecologists: No. 82, June 2007: Management of herpes in pregnancy. Obstet Gynecol 2007;109(6):1489-98.
- Hollier LM, Wendel GD. Third trimester antiviral prophylaxis for preventing maternal genital herpes simplex virus (HSV) recurrences and neonatal infection. Cochrane Database Syst Rev 2008;(1):CD004946.
- Money D, Steben M, Wong T et coll. Guidelines for the management of herpes simplex virus in pregnancy. J Obstet Gynaecol Can 2008;30(6):514-26.
- Royal College of Obstetricians and Gynaecologists. Genital herpes in pregnancy, Management (Green-top 30), 2e éd. 2007: www.rcog.org.uk/files/rcog-corp/uploadedfiles/GT30GenitalHerpes2007.pdf (consulté le 16 janvier 2014).
- Nahmias AJ, Josey WE, Naib ZM, Freeman MG, Fernandez RJ, Wheeler JH. Perinatal risk associated with maternal genital herpes simplex virus infection. Am J Obstet Gynecol 1971;110(6):825-37.
- Parvey LS, Ch’ien LT. Neonatal herpes simplex virus infection introduced by fetal-monitor scalp electrodes. Pediatrics 1980;65(6):1150-3.
- Kaye EM, Dooling EC. Neonatal herpes simplex meningoencephalitis associated with fetal monitor scalp electrodes. Neurology 1981;31(8):1045-7.
- Kohelet D, Katz N, Sadan O, Somekh E. Herpes simplex virus infection after vacuum-assisted vaginally delivered infants of asymptomatic mothers. J Perinatol 2004;24(3):147-9.
- Kimberlin DW. Herpes simplex virus infections of the newborn. Semin Perinatol 2007;31(1):19-25.
- Kimberlin DW, Lin CY, Jacobs RF et coll. Natural history of neonatal herpes simplex virus infections in the acyclovir era. Pediatrics 2001;108(2):223-9.
- Long SS, Pool TE, Vodzak J, Daskalaki I, Gould JM. Herpes simplex virus infection in young infants during 2 decades of empiric acyclovir therapy. Pediatr Infect Dis J 2011;30(7):556-61.
- Adamiak B, Trybala E, Mardberg K et coll. Human antibodies to herpes simplex virus type 1 glycoprotein C are neutralizing and target the heparan sulfate-binding domain. Virology 2010;400(2):197-206.
- Malm G, Berg U, Forsgren M. Neonatal herpes simplex: Clinical findings and outcome in relation to type of maternal infection. Acta Paediatr 1995;84(3):256-60.
- Whitley RJ, Yeager A, Kartus P et coll. Neonatal herpes simplex virus infection: Follow-up of vidarabine therapy. Pediatrics 1983;72(6):778-85.
- Kimberlin DW, Jacobs RF, Powell DA et coll. Safety and efficacy of high-dose acyclovir in the management of neonatal herpes simplex virus infections. Pediatr 2001;108(2);230-8.
- Whitley R, Arvin A, Prober C et coll. Predictors of morbidity and mortality in neonates with herpes simplex infections: The National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group. N Engl J Med 1991;324(7):450-4.
- Kimberlin DW, Whitley RJ, Wan W et coll. Oral acyclovir suppression and neurodevelopment after neonatal herpes. N Engl J Med 2011;365(14):1284-92.
- Kimura H, Futamura M, Kito H et coll. Detection of viral DNA in neonatal herpes simplex virus infections: Frequent and prolonged presence in serum and cerebrospinal fluid. J Infect Dis 1991;164(2):289-93.
- Wada K, Mizoguchi S, Ito Y et coll. Multiplex real-time PCR for the simultaneous detection of herpes simplex virus, human herpesvirus 6, and human herpesvirus 7. Microbiol Immunol 2009;53(1):22-9.
- Kimura H, Ito Y, Futamura M et coll. Quantitation of viral load in neonatal herpes simplex virus infection and comparison between type 1 and type 2. J Med Virol 2002;67(3):349-53.
- Tod M, Lokiec F, Bidault R, De Bony F, Petitjean O, Aujard Y. Pharmacokinetics of oral acyclovir in neonates and in infants: A population analysis. Antimicrob Agents Chemother 2001;45(1):150-7.
- Demmler-Harrison GJ. Neonatal herpes simplex virus infection: Management and prevention. UpToDate, 2013. www.uptodate.com/contents/neonatal-herpes-simplex-virus-infectionmanagement-and-prevention (consulté le 20 janvier 2014).
- Sanchez PJ, Demmler-Harrison GJ. Viral infections of the fetus and neonate. In: Feigin RD, Cherry JD, éd. Textbook of Pediatric Infectious Diseases, 6e éd. Philadelphie: Saunders, 2009:895.
- Santé Canada, Prévention et contrôle des maladies infectieuses, 2012. Pratiques de base et précautions additionnelles visant à prévenir la transmission des infections dans les milieux de soins. www.ipac-canada.org/pdf/2013_PHAC_RPAP-FR.pdf (consulté le 20 janvier 2014).
Avertissement : Les recommandations du présent document de principes ne constituent pas une démarche ou un mode de traitement exclusif. Des variations tenant compte de la situation du patient peuvent se révéler pertinentes. Les adresses Internet sont à jour au moment de la publication.
Mise à jour : le 8 février 2024

